
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.升高温度,n(CO)减少B.减小压强,n(CO2)增加
C.更换高效催化剂,CO的转化率增大D.充入一定量的氮气,n(H2)不变
科目:高中化学 来源: 题型:
【题目】冰晶石又名六氟铝酸钠(Na3A1F6)白色固体,微溶于水,常用作电解铝工业的助熔剂。工业上用萤石(主要成分是CaF2)、浓硫酸、氢氧化铝和碳酸钠溶液通过湿法制备冰晶石,某化学实验小组模拟工业上制取Na2AlF6的装置图如下(该装置均由聚四氟乙烯仪器组装而成)。
已知:CaF2+H2SO4![]() CaSO4+2HF↑
CaSO4+2HF↑
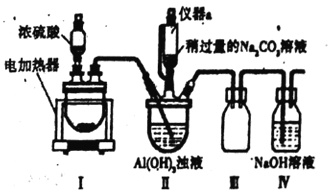
(1)实验仪器不能使用玻璃仪器的原因是_____________(用化学方程式表示)。
(2)装置III的作用为______________________。
(3)在实验过程中,装置II中有CO2气体逸出,同时观察到有白色固体析出,请写出该反应的离子反应方程式:__________________。
(4)在实验过程中,先向装置II中通入HF气体,然后再滴加Na2CO3溶液,而不是先将Na2CO3和A1(OH)3混合后再通入HF气体,其原因是_______________。 .
(5)装置II反应后的混合液经过过滤可得到Na3A1F6晶体,在过滤操作中确定沉淀已经洗涤干净的方法是_____________________。
(6)在电解制铝的工业生产中,阳极的电极反应式为_____________。
(7)萤石中含有少量的Fe2O3杂质,可用于装置I反应后的溶液来测定氟化钙的含量。具体操作如下:取8.0 g萤石加入装置I中,完全反应后,将混合液加稀释,然后加入足量的KI固体,再以淀粉为指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定,当出现_________现象时,到达滴定终点,消耗Na2S2O3标准溶液40.00mL,则萤石中氟化钙的百分含量为______________。(已知:I2+2S2O32-==S4O62-+2I-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人们的日常生活密切相关,下列叙述正确的是![]()
A.水玻璃可用于生产黏合剂和防火剂
B.纤维素、油脂是天然有机高分子化合物
C.白菜上洒少许福尔马林,既保鲜又消毒
D.棉、麻、合成纤维完全燃烧都只生成![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的表达正确的是( )
A. 结构示意图为![]() 的阴离子都不能破坏水的电离平衡
的阴离子都不能破坏水的电离平衡
B. 邻硝基甲苯的结构简式为![]() ,能发生取代反应
,能发生取代反应
C. 钾长石(KAlSi3O8)写成氧化物形式为:K2OAl2O36SiO2
D. 反应的电子转移情况: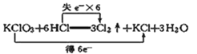
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:

已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有____。
a.适当升高温度 b.搅拌 c.加适量纯碱 d.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是__________________________。
(3)调节pH为5.4~5.8的目的是______________。
(4)滤渣3的主要成分的化学式是_______。
(5)采用50℃碳化的原因是_________________________________。该过程发生反应的离子方程式是__________________。
(6)检验碳酸锰产品完全洗净的方法是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:

(1)反应达到平衡时,平衡常数表达式K=__,升高温度,K值__(填“增大”“减小”或“不变”),该反应是___反应(填“吸热”或“放热”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)__。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__(填选项字母)。
,下列有关该体系的说法正确的是__(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H 2 )/n(CH 3 OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两者互为同分异构体,E被氧化成A,A继续氧化成B,C、F都能发生加聚反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
(1)A.______、B.______、C.______、D.______、E.______、F.______。
(2)写出下列反应的化学方程式
E→A:_________________________________________。
实验室制备C:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①:2C(s)+O2(g)═2CO(q)△H=﹣221.0kJ/mol②2H2(q)+O2(q)═2H2O(g)△H=﹣483.6kJ/mol,则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
A.262.6kJ/mol B.﹣131.3kJ/mol C.﹣352.3kJ/mol D.+131.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质 | Br2 | CCl4 | 正十二烷 |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
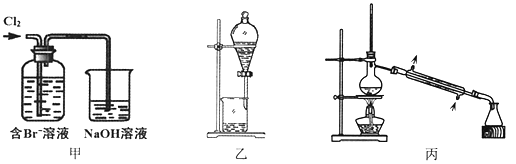
下列说法不正确的是
A. 甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B. 甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C. 用乙装置进行萃取,溶解Br2的有机层在下层
D. 用丙装置进行蒸馏,先收集到的是Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com