
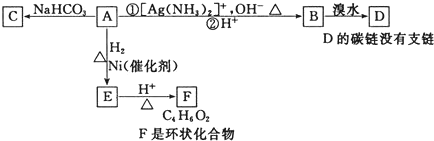
| A. | 化合物A中一定含有的官能团是醛基、羧基和碳碳双键 | |
| B. | 由A生成E发生还原反应 | |
| C. | F的结构简式可表示 | |
| D. | 由B生成D发生加成反应 |
分析 根据题中各物质转化关系,A能与碳酸氢钠反应生成二氧化碳,说明A中有羧基,A能与银氨溶液反应,说明A中有醛基,生成物B能与溴水加成得D,D没有支链,说明A中有碳碳双键,A与氢气发生加成反应生成E,E能生成环状化合物F,根据F的分子式可知,A应为OHCCH=CHCOOH或OHCC≡CCOOH,推断得B为HOOCCH=CHCOOH,C为OHCCH=CHCOONa,D为HOOCCHBrCHBrCOOH,E为HOCH2CH2CH2COOH,F为 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,A能与碳酸氢钠反应生成二氧化碳,说明A中有羧基,A能与银氨溶液反应,说明A中有醛基,生成物B能与溴水加成得D,D没有支链,说明A中有碳碳双键,A与氢气发生加成反应生成E,E能生成环状化合物F,根据F的分子式可知,A应为OHCCH=CHCOOH,推断得B为HOOCCH=CHCOOH,C为OHCCH=CHCOONa,D为HOOCCHBrCHBrCOOH,E为HOCH2CH2CH2COOH,F为 ,
,
A、根据上面的分析可知,A应为OHCCH=CHCOOH或OHCC≡CCOOH,可能含有碳碳参键,故A错误;
B、由A生成E,是与氢气发生加成,所以是还原反应,故B正确;
C、根据上面的分析可知,F的结构简式可表示 ,故C正确;
,故C正确;
D、由B与溴发生加成反应生成D,故D正确,
故选A.
点评 本题考查有机物的推断,难度中等,根据A的性质推断A的结构是解题的关键,根据反应条件及反应信息利用正推法与逆推法相结合进行判断,是对有机物知识的综合考查,能较好的考查学生的阅读、分析与思维能力,是有机热点题型.


科目:高中化学 来源: 题型:选择题
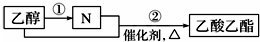
| A. | N为乙酸 | |
| B. | 可用饱和碳酸钠溶液除去乙酸乙酯中混有的N | |
| C. | 过程①中可加入LiAlH4等还原剂将乙醇转化为N | |
| D. | 过程②如果加热一段时间后发现忘记加碎瓷片,应停止反应,待冷却后补加 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③⑤ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
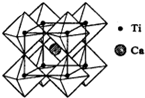 钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状态下,22.4L氯化氢中含有氯原子的数目为NA | |
| B. | 常温常压下,7.0g乙烯与丙稀的混合物中含有碳原子的数目为NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com