
【题目】含SO2废气的治理可以变废为宝,使硫资源得以利用。
(1)按每年全国发电燃煤8亿吨,煤中含硫质量分数以2%计,若不经过脱硫处理,则会有_______亿吨SO2排放到大气中(假设S全部转化为SO2)。
(2)下列物质中,能吸收SO2的有_____(填序号)。
a.氨水 b.酸性KMnO4溶液 c.生石灰 d.Na2CO3溶液
(3)某工厂采用(NH4)2SO3和NH4HSO3的混合溶液A吸收烟气中的SO2并制备(NH4)2SO3 ·H2O过程如下:
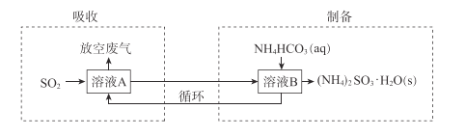
已知: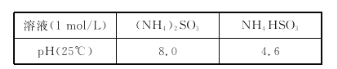
①“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3的物质的量之比变____(填 “大”或“小”)。
②(NH4)2SO3溶液呈碱性的原因是_____。
③用不同的溶液A吸收SO2时,SO2吸收率和放空废气含NH3量的变化如下图。解释图中放空废气含NH3量增大的原因:随(NH4)2SO3的物质的量之比增大,_______。
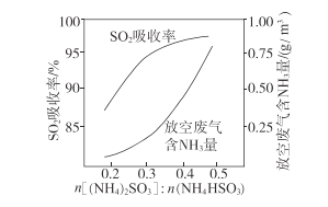
注:不同溶液A的体积相同,所含(NH4)2SO3和NH4HSO3的总物质的量相同。
④“制备”过程中,溶液B中发生的反应方程式是______。
(4)检验产品(NH4)2SO3 ·H2O中含有少量SO42-的方法如下:取少量产品加水溶解,_____(将实验操作和现象补充完整〕。
【答案】0.32 abcd 小 ![]() 、
、![]() 都水解,前者程度更大,使溶液中c(OH-)>c(H+) 溶液中c(
都水解,前者程度更大,使溶液中c(OH-)>c(H+) 溶液中c(![]() )和c(OH-)均增大,使
)和c(OH-)均增大,使![]() + H2O NH3·H2O + H+平衡向右移动,促使NH3逸出 NH4HCO3 + NH4HSO3 = (NH4)2SO3·H2O↓ + CO2↑ 加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生
+ H2O NH3·H2O + H+平衡向右移动,促使NH3逸出 NH4HCO3 + NH4HSO3 = (NH4)2SO3·H2O↓ + CO2↑ 加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生
【解析】
(1)直接以亿吨作为单位进行演算。相同物质的量时,SO2的质量恰是S的2倍。所以生成的二氧化硫的质量为:8亿吨×2%×2=0.32亿吨,所以答案为0.32;(2)SO2能与所给的四种物质都反应。反应方程式分别为:SO2+2NH3H2O=(NH4)2SO3+H2O,SO2+NH3H2O=NH4HSO3,5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,SO2+CaO=CaSO3,SO2+2Na2CO3+H2O=Na2SO3+2NaHCO3,所以答案为:abcd;(3)①“吸收”的过程,就是溶液(NH4)2SO3转化为NH4HSO3的过程,所以“吸收”过程中,溶液中(NH4)2SO3和NH4HSO3物质的量之比将变小,所以答案为:变小;②NH4++H2ONH3H2O+H+,SO32-+H2OHSO3-+OH-,溶液呈碱性,说明SO32-的水解程度比NH4+的水解程度大;所以答案为:SO32-、NH4+都水解,前者程度更大,使溶液中c(OH-)>c(H+);③从NH4+的水解平衡的移动的角度来解释。溶液中c(NH4+)和c(OH-)均增大,均使NH4++H2ONH3·H2O+H+平衡向右移动,促使溶液中的NH3逸出;④溶液B有(NH4)2SO3和NH4HSO3,加入NH4HCO3,只有酸性的NH4HSO3溶液与其反应:NH4HCO3+NH4HSO3 =(NH4)2SO3·H2O↓+CO2↑。所以答案为:NH4HCO3 +NH4HSO3 = (NH4)2SO3·H2O↓+CO2↑;(4)SO42-的检验,通常要先加过量的盐酸,排除干扰离子,再加BaCl2溶液进行检验。所以答案为:加过量盐酸,充分振荡,再加氯化钡溶液,有白色沉淀产生。


科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g) ![]() Z(g)(正反应为放热反应)该反应经过60 s达到化学平衡,生成0.3 mol Z,下列说法正确的是( )
Z(g)(正反应为放热反应)该反应经过60 s达到化学平衡,生成0.3 mol Z,下列说法正确的是( )
A. 以X浓度变化表示的反应速率为0.01 mol·(L·s)-1
B. 当X、Y、Z的速率比为2:1:1时,达到化学平衡状态
C. 反应放出的热量可用于提高反应速率
D. 反应达到平衡时,n(X):n(Y)=1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是
|
|
|
|
A.开启啤酒瓶后,瓶中马上泛起大量泡沫 | B.由I2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深 | C.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出 | D.石灰岩受地下水长期溶蚀形成溶洞 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2═2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈。下列说法正确的是( )
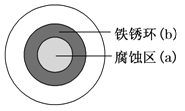
A. 液滴中的Cl﹣ 由a区向b区迁移
B. 铁腐蚀严重的区域,生锈也严重
C. 液滴下的Fe因发生还原反应而被腐蚀
D. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e﹣═4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化学反应方程式:
(1)乙醇催化氧化:_____;
(2)苯与浓硝酸、浓硫酸共热:_____;
(3)硬脂酸甘油脂的皂化反应:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB![]() pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
pC(g)+qD中,A和C都是无色气体,达到平衡后,下列叙述正确的是
A. 若增加B的量,平衡体系颜色加深,说明B必是气体
B. 增大压强,平衡不移动,说明m+n一定等于p+q
C. 升高温度,A的转化率减小,说明正反应是吸热反应
D. 若B是气体,增大A的量,A、B的转化率都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作规范且能达到目的是
目的 | 操作 | |
A | 比较Cl和Br的非金属性强弱 | 测pH,比较同浓度的HCl和HBr的酸性强弱 |
B | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C | 海带提碘中的氧化工序 | 可以用硝酸代替氯水 |
D | 将四氯化碳中的碘单质提取出来 | 可通过反萃取法 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com