
【题目】全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+ . 下列说法正确的是( )
VO2++2H++V2+ . 下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e﹣=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极
D.放电过程中,H+由正极移向负极
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,书写不正确的是( )
A.Ca(OH)2=Ca2++2OH-B.NaOH=Na++O2-+H+
C.HCl=H++Cl-D.KHCO3=K++HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
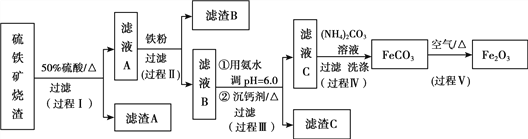
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
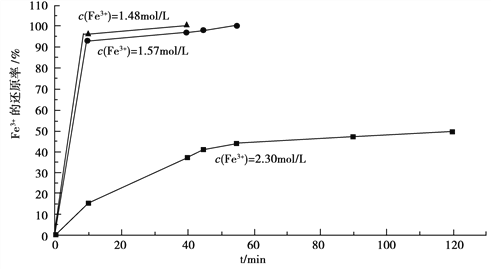
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
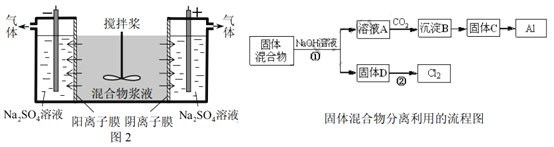
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:
(1)Zn原子基态核外电子排布式为_____________________________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①与SO42-互为等电子体的阴离子化学式为________________(写出一种)
②氨的热稳定性强于膦(PH3),原因是____________________________。
(3)黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1,IZn=906 kJ·mol-1,ICu< IZn的原因是___________________。
(4)《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是_________________。ZnCO3中阴离子的立体构型是_____________________。
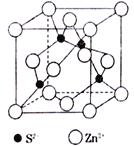
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为________________。晶胞边长为apm,阿伏加德罗常数的值为NA,则ZnS晶体的密度为 __________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 常温常压下28g N2所含电子数为10NA
B. 46g 钠充分燃烧时转移电子数为2NA
C. 0.1mol/L NH4Cl溶液中NH4+离子数小于0.1NA
D. 密闭容器中3mol NO与1molO2充分反应,剩余气体的分子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产、生活中产生的废水、废气是环境污染的重要源头。在环境治理方面人们可利用I2O5和Na2SO3等化工产品实现对废水和废气的治理。
(1)利用I2O5的氧化性处理废气H2S,得到S、I2两种单质,发生反应的化学方程式为________________。
(2)利用I2O5也可消除CO的污染,其反应原理为I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
5CO2(g)+I2(s) ΔH。已知在不同温度(T1、T2)下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体的体积分数φ(CO2)随时间t的变化曲线如图所示。
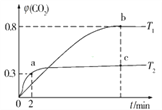
①温度为T2时,0~2 min 内,CO2的平均反应速率 υ(CO2)=______________。
②b点时CO的转化率为_______,化学反应的平衡常数K=_____(填表达式)。
③反应:I2O5(s)+5CO(g)![]() 5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
5CO2(g)+I2(s)的ΔH______0(填“>”“<”或“=”)。
④上述反应在T1下达到平衡时,再向容器中充入物质的量均为2 mol的CO和CO2气体,则化学平衡________(填“向左” “向右”或“不”)移动。
⑤下列现象,可以表示上述反应达到平衡状态的是____________(填字母)。
A.容器内的压强不再变化 B.混合气的平均相对分子质量不再变化
C.混合气的密度不再变化 D.单位时间内消耗CO和生成CO2的物质的量之比为1∶1
(3)Na2SO3具有还原性,其水溶液可以吸收Cl2(g),减少环境污染。
已知反应:
①Na2SO3(aq)+Cl2(g)+H2O(l) ![]() Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
Na2SO4(aq)+2HCl(aq) ΔH1=a kJ·mol1
②Cl2(g)+H2O(l) ![]() HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
HCl(aq)+HClO(aq) ΔH2=b kJ·mol1
试写出Na2SO3(aq)与HClO(aq)反应的热化学方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )

A. 一元酸HA为弱酸
B. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C. pH=7时,c(Na+)>c(A-)+c(HA)
D. b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 乙烯的比例模型:![]() B. S2-的结构示意图:
B. S2-的结构示意图:![]()
C. KCl的电子式:![]() D. 丙烯的结构简式:CH3CH=CH2
D. 丙烯的结构简式:CH3CH=CH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com