
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
分析 根据中心原子价层电子对互斥理论确定其空间构型,中心原子含有4个价层电子对,而且不含有孤电子对的分子为正四面体.
解答 解:A、CH4中中心原子价层电子对个数=4+$\frac{1}{2}$(4-2×2)=4,而且不含有孤电子对,分子空间构型为正四面体,故A正确;
B、NH3中中心原子价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,含有1个孤电子对,分子空间构型为三角锥形,故B错误;
C、H2O中中心原子价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,含有2个孤电子对,分子空间构型为V形,故C错误;
D、CO2中中心原子价层电子对个数=2+$\frac{1}{2}$(4-2×2)=2,分子空间构型为直线形,故D错误;
故选A.
点评 本题主要考查了价层电子对互斥理论的运用,题目难度不大,注意把握孤电子对数的计算法.


科目:高中化学 来源: 题型:选择题
| A. | 实验室用排水集气法收集氧气完毕,把导管从水中取出,然后移去酒精灯 | |
| B. | 氢气还原氧化铜的实验结束,先移去酒精灯,待试管冷却后再停止通氢气 | |
| C. | 倾倒液体进行过滤时,应使液体沿着玻璃棒流下,且液面低于滤纸边缘 | |
| D. | 因NaOH有腐蚀性,可在天平两托盘上放同样的滤纸后再放NaOH,然后进行称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b=$\frac{n}{22.4}$ | B. | b=$\frac{22.4}{n}$ | C. | b=$\frac{n}{11.2}$ | D. | b=11.2n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
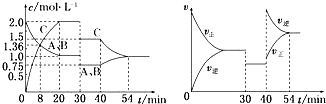
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
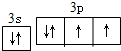 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③② | B. | ③②① | C. | ②③① | D. | ②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
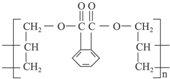 合成它的单体可能有( )
合成它的单体可能有( )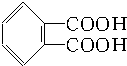 ) ②丙烯醇(CH2═CH-CH2OH)
) ②丙烯醇(CH2═CH-CH2OH) | A. | ①② | B. | ③④ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com