
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:分析 A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子,则A为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布式为1s22s22p2,则B为碳元素;C与B同周期,核外有三个未成对电子,原子核外电子排布式为1s22s22p3,故C为N元素;D元素的基态原子核外有8种运动状态的电子,则D为O元素;F元素的正三价离子的3d轨道为半充满,外围电子排布式为3d64s2,则F为Fe;E元素的最高正价与最低负价的代数和为4,最外层电子数为6,原子序数小于Fe,则E为S元素.
解答 解:A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子,则A为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,原子核外电子排布式为1s22s22p2,则B为碳元素;C与B同周期,核外有三个未成对电子,原子核外电子排布式为1s22s22p3,故C为N元素;D元素的基态原子核外有8种运动状态的电子,则D为O元素;F元素的正三价离子的3d轨道为半充满,外围电子排布式为3d64s2,则F为Fe;E元素的最高正价与最低负价的代数和为4,最外层电子数为6,原子序数小于Fe,则E为S元素.
(2)氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于氧元素的,同主族自上而下第一电离能减小,故第一电离能大小顺序是:N>O>S,SO42-中S原子孤电子对数=$\frac{6+2-2×4}{2}$=0,价层电子对数=4+0=4,空间构型为正四面体,SO32-中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,杂化轨道数目=3+1=4,S原子采取sp3杂化,
故答案为:N>O>S;正四面体;sp3;
(2)离子化合物CA5为NH4H,铵根离子与氢负离子之间形成离子键,铵根离子中含有配位键、极性键,
故选:ABD;
(3)金属配合物Fe(CO)n的中心原子价电子数与配体提供电子总数之和为18,Fe原子价电子水为8,则8+2n=18,故n=5,
故答案为:5;
(4)N2O分子与CO2核外等电子体,结构式为N=N=O,分子中σ键和π键数目比是1:1,
故答案为:1:1;
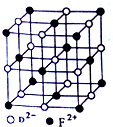
(5)FD晶胞结构如图所示,FeO晶体中O2-、Fe2+为1:1,O2-的配位数为6,则Fe2+配位数为6,晶胞中O2-离子数目为1+12×$\frac{1}{4}$=4,则Fe2+的数目也是4,晶胞质量为4×$\frac{72}{{N}_{A}}$g,若该晶胞边长为a cm,则该晶体密度为4×$\frac{72}{{N}_{A}}$g÷(a cm)3=$\frac{288}{{N}_{A}×{a}^{3}}$g/cm3,
故答案为:6;$\frac{288}{{N}_{A}×{a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型判断、化学键、晶胞计算等,(4)中注意利用等电子体判断一氧化二氮的结构,理解同周期第一电离能异常原因,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
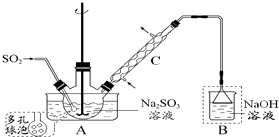 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
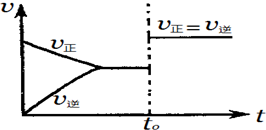
| A. | 若a+b=c,则t0时可能是增大反应体系的压强 | |
| B. | 若a+b=c,则t0时不可能是加入催化剂 | |
| C. | 若a+b≠c,则t0时只可能是加入催化剂 | |
| D. | 若a+b≠c,则t0时有可能是增大反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH均为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 | |
| B. | (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | |
| C. | 0.2mol/L的CH3COOH溶液与0.1mol/L和CH3COOH溶液中c(H+)之比 | |
| D. | 0.2mol/L的HCl与0.1mol/LHNO3溶液中n(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M点溶液中水的电离程度比原溶液小 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiH4分子呈正四面体形 | |
| B. | SiH4分子是非极性分子 | |
| C. | 因为Si-H键键能比C-H键键能低,所以SiH4沸点低于CH4沸点 | |
| D. | SiH4分子稳定性低于CH4分子,因为C-H键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、AlO2- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Fe2+、K+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com