
分析 (1)一般金属元素与非金属元素形成离子键,不同非金属元素之间形成极性共价键,同种非金属元素之间形成非极性共价键,以此来解答;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2;若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2;
(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;共价化合物在熔融状态下不导电;
解答 解:①O2、②H2、⑩I2中只含有非极性共价键;
⑥CH4、⑦CO2、⑨NH3中只含有极性共价键;
⑧NaF中只含有离子键;
④K2O2中钾离子与过氧根离子以离子键结合,O、O之间以非极性共价键结合,既有离子键又有非极性键;
③NH4NO3中氯离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子之间、硝酸根离子中氮原子和氧原子之间存在极性共价键,既有离子键又有极性键;
⑤Ba(OH)2中钡离子和氢氧根离子间存在离子键,氢氧根离子中氧原子和氢原子之间存在极性共价键,既有离子键又有极性键;
故答案为:①②⑩;⑥⑦⑨;④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,XY2中共有38个电子,若XY2为常见元素形成的离子化合物,X为第IIA族元素、Y为第VIIA族元素,其电子数是38,则为CaF2,若XY2为共价化合物时,则X为第IVA族元素、Y为第VIA族元素,其电子数为38,则为CS2,其结构式为S=C=S;
故答案为:CaF2;S=C=S;
(3)氯化铝的熔点为190℃,但在180℃就开始升华,熔点较低,应为共价化合物;氯化铝在熔融状态下不导电,说明为共价化合物;
故答案为:共价;氯化铝在熔融状态下不导电.
点评 本题考查了化学键、共价化合物、结构式和元素的推断综合应用等知识点,根据物质的构成微粒确定化学键类型,知道8电子稳定结构的判断方法,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全 | |
| B. | 在“火柴头中氯元素的检验”实验中,摘下几根未燃过的火柴头,将其浸于水中,稍后取少量溶液于试管中,滴加硝酸银和稀硝酸溶液后,即可判断氯元素的存在 | |
| C. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| D. | 用纸层析法分离铁离子与铜离子时,蓝色斑点在棕色斑点的下方,说明铜离子在流动相中分配得更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
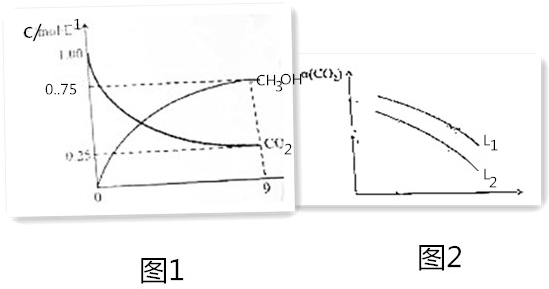
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
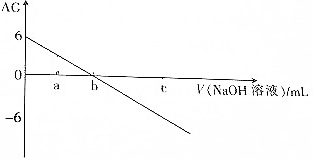
| A. | 若a点加入NaOH溶液的体积为10mL,则溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | b点加入NaOH溶液的体积为20mL | |
| C. | b点时,溶液中存在:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 若c点加入NaOH溶液的体积为40mL,则溶液中:c(CH3COO-)+2c(CH3C00H)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
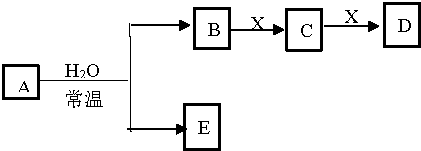
| A. | 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐 | |
| B. | 若X是Na2SO3,C是气体,则A可能是氯气,且D和E能发生反应 | |
| C. | 若D是CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 | |
| D. | 若A是单质,B和D的反应是,则E一定能还原Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过加热鉴别Na2CO3和NaHCO3 | B. | 通过加水溶解鉴别Na2O和Na2O2 | ||
| C. | 通过焰色反应鉴别NaCl和KCl | D. | 通过纸上层析法鉴别CuCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
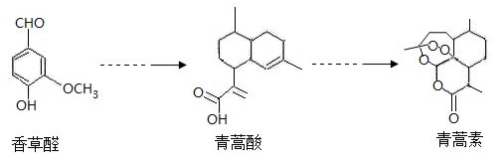
| A. | 青蒿素能发生水解反应 | |
| B. | 青蒿素易溶于乙醚 | |
| C. | 在一定条件下,香草醛可与HCHO发生缩聚反应 | |
| D. | 可用FeCl3 溶液或 NaHCO3溶液鉴别香草醛和青蒿酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com