
| A、1 mol过氧化钠中阴离子所带的负电荷数为NA |
| B、14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA |
| C、28 g C16O与28 g C18O中含有的质子数均为14 NA |
| D、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA |


科目:高中化学 来源: 题型:
| 元素 | X | Y | Z | W | R |
| 性质信息 | 能形成+7价的化合物 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子 | 焰色反应为黄色 | 位于第IVA,是形成化合物种类最多的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸铜溶液与氢氧化钡溶液反应:SO
| ||
B、将大理石投入到足量盐酸中:CO
| ||
| C、将Cl2通入KI溶液中:I-+Cl2═Cl-+I2 | ||
| D、向AlCl3溶液中加入过量的氨水反应:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钾与水反应,生成了1mol H2,发生转移的电子数目为2NA |
| B、23g金属钠所含电子数目为11NA |
| C、在标准状况下,NA个氢分子的体积约为22.4L |
| D、醋酸的摩尔质量与NA个醋酸分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4O C3H4O5 |
| B、C3H6 C4H6O3 |
| C、C2H2 C6H6 |
| D、C3H8 C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| B、由N2O4(g)?2NO2(g)△H=-56.9kJ?mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C、由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3kJ |
| D、已知101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则1mol碳完全燃烧生成CO2放出的热量大于110.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于0.8mol |
| B、小于0.8mol |
| C、大于0.6mol |
| D、等于0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 |  |
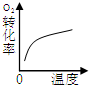 |
 |
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com