
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. pH=1的溶液中:Fe2+、NO3﹣、Na+、SO42﹣
B. 水电离出的c(H+)=10﹣12mol/L的溶液中:Ca2+、K+、Cl﹣、HCO3﹣
C. c(H+)/c(OH—)=1012的水溶液中:NH4+、Al3+、NO3﹣、Cl﹣
D. c(Fe3+)=0.1mol/L的溶液中:K+、ClO﹣、SO42﹣、SCN-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
2SO3(g)△H=﹣QkJ/mol,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ。则Q1、Q2、Q满足的关系是( )
A.Q2=![]() B.Q2>
B.Q2>![]() C.Q2<Q1<Q D.Q=Q1>Q2
C.Q2<Q1<Q D.Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,CH4和CO燃烧的热化学方程式分别为:
CH4(g)+2O2(g)![]() 2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2H2O(l)+CO2(g) ΔH =﹣890 kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH =﹣566 kJ/mol
2CO2(g) ΔH =﹣566 kJ/mol
如果有CH4和CO的混合气体充分燃烧,放出的热量为262.9 kJ,生成的CO2用过量的饱和石灰水完全吸收,得到50g白色沉淀。则混合气体中CH4和CO的体积比为( )
A.1∶2B.1∶3C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
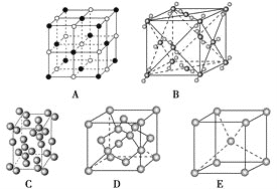
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
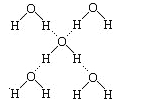
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中正确的是( )
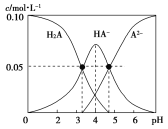
A.在c(Na+)=0.10mol·L-1的溶液中:c(A2-)-c(H+)=c(H2A)-c(OH-)
B.pH=4的溶液中:c(HA-)=c(H2A)+c(A2-)
C.pH=7的溶液中:c(Na+)=c(A2-)+c(HA-)
D.Ka1(H2A)的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
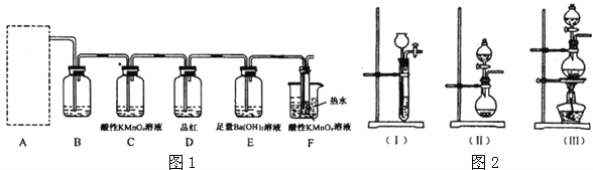
试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应mA(g)+nB(g)![]() pC(g)+qD(g)在一密闭容器中进行,测得平均反应速度v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速度v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
A.2、6、3、5B.3、1、2、2
C.3、1、2、1D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写2种)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、低温烘干。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com