
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
科目:高中化学 来源:不详 题型:单选题
| A.金属的颜色和熔沸点 |
| B.金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C.1mo金属单质在反应中失去电子的多少 |
| D.金属元素的单质和水或酸置换出氢的难易 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
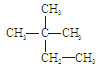 ③白磷 ④18O ⑤
③白磷 ④18O ⑤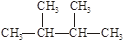
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氘原子中的质子和中子 |
| B.Na2O2固体中的阴离子和阳离子 |
| C.CO2分子中的σ键和π键 |
| D.常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | X | | Y |
| Z | | W | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
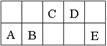
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
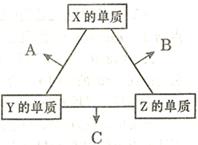
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com