
 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
分析 (1)据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
(1)根据平衡移动判断反应的热量变化;
(2)根据平衡常数和浓度商的大小,来判断反应进行的方向;
(3)①反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此判断;
②正反应放热,则升高温度CO的转化率降低;a 点CO的转化率为50%,以此计算氢气的物质的量浓度的变化,进而计算反应速率;
(4)负极发生氧化反应,电极反应式为:CH4-8e-+4CO32-=CO2+2H2O;根据Q=It和N=$\frac{Q}{e}$结合CH4-8e-+4CO32-=CO2+2H2O计算.
解答 解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
②CO(g)+H2O(g)═H2(g)+CO2(g);△H=-41.2kJ•mol-1
③2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ•mol-1
由盖斯定律可知,①+2×②-2×③得CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.3kJ/mol,故答案为:+247.3kJ/mol;
(1)温度升高,平衡常数增大即平衡向正反应方向移动,故该反应为吸热反应,故答案为:>;
(2)已知800℃时,向1L密闭容器中投入0.5molCH4、0.5mol H2O、0.5molH2和0.5molCO,所以Qc=$\frac{0.5×0.{5}^{3}}{0.5×0.5}$=0.25<0.45=K,说明平衡正向移动,故答案为:正向移动;
(3)①A、混合气体的平均式量保持不变,说明气体的总物质的量不变,反应达到平衡,故A正确;
B、混合气体的压强不变,说明气体的总物质的量不变,反应达到平衡,故B正确;
C、混合气体的密度始终保持不变,故C错误;
D、反应达平衡状态时应有v逆(H2)=2v正(CH3OH),故D错误;
故答案为:AB;
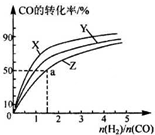
②该反应为放热反应,温度越高CO的转化率越小,所以曲线X为200℃,由图象可知曲线Z为260℃,
a 点CO的转化率为50%,则△n(CO)=0.5mol,△n(H2)=1mol,
H2的反应速率为$\frac{\frac{1mol}{2L}}{5min}$=0.1mol/(L•min),
故答案为:260℃; 0.1mol/(L•min);
(4)负极发生氧化反应,电极反应式为:CH4-8e-+4CO32-=5CO2+2H2O;根据Q=It=1.6A×60s=96C,N=$\frac{Q}{e}$=$\frac{96C}{1.6×1{0}^{-19}C}$=6×1020个,
由CH4~~~~8e-
22.4 8×6×1023
V 6×1020
$\frac{22.4}{V}=\frac{8×6×1{0}^{23}}{6×1{0}^{20}}$
解之得:V=0.0028L=2.8mL,故答案为:CH4-8e-+4CO32-=5CO2+2H2O;2.8.
点评 本题综合性较大,涉及化学平衡常数、化学平衡影响因素以及电化学知识等,为高考常见题型,侧重于学生的分析、计算能力的考查,难度较大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们相差一个电子层 | B. | 它们的化学性质相似 | ||
| C. | 钠原子,钠离子均为同一元素 | D. | 它们的最外层电子数不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m1>m2时,溶液a中的阴离子只有1种 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在常温下,某水溶液M中.
在常温下,某水溶液M中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
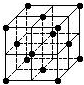
| A. | C60摩尔质量是720 | |
| B. | C60属于离子晶体 | |
| C. | 在C60晶胞中有14个C60分子 | |
| D. | 每个C60分子周围与它距离最近等距离的C60分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O的质量为18g/mol | |
| B. | O2 的摩尔质量为32g | |
| C. | 2mol NaOH 溶于1 L水中配成溶液的浓度为2mol/L | |
| D. | 6.02×1023个CO分子的质量约为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯是发生取代反应 | |
| C. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| D. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com