
【题目】物质C是升高白细胞的常见药物设计合成C的路线如下图所示:

已知:

请回答下列问题:
(1)①的反应条件为____;A中官能团的名称是_____。
(2)试剂X的结构简式为____,④的化学方程式为________,其反应类型为_____。
(3)物质B与H2按照物质的量之比1:1加成得到物质T。写出一种符合下列条件的T的同分异构体的结构简式____________。
①属于芳香族化合物
②lmol该物质与足量碳酸氢钠溶液反应生成2 mol CO2
③核磁共振氢谱有2组吸收峰,其面积比为6:2
(4)以R″—CHO代表X写出X与苯酚在一定条件下形成高聚物的化学方程式____。
(5)设计以甲醛、乙醛为原料合成 的路线(无机试剂任选)_____________。
的路线(无机试剂任选)_____________。
【答案】NaOH水溶液,△ 醛基 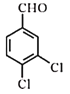
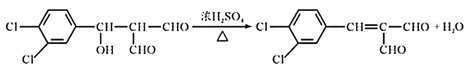 消去反应
消去反应 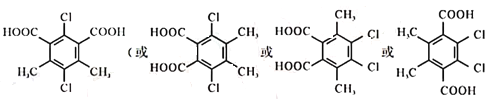 等其它合理也可
等其它合理也可 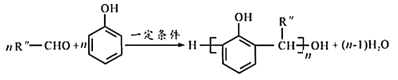
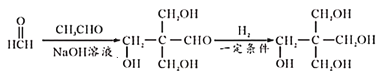
【解析】
①反应是卤代烃![]() 在NaOH水溶液中加热,水解生成
在NaOH水溶液中加热,水解生成![]() ,②
,②![]() 催化氧化生成
催化氧化生成![]() ,A为
,A为![]() ,由信息
,由信息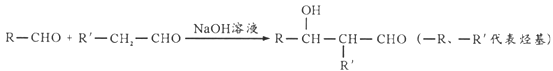 得X为
得X为 ,A与X发生反应③得
,A与X发生反应③得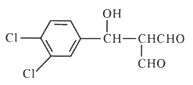 ,④浓硫酸、加热的条件下发生消去反应生成
,④浓硫酸、加热的条件下发生消去反应生成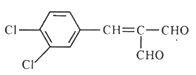 ,再发生银镜反应,被氧化成羧酸盐,酸化后生成B,B为
,再发生银镜反应,被氧化成羧酸盐,酸化后生成B,B为 ,B经反应⑥脱羧得C,
,B经反应⑥脱羧得C,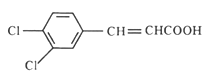 。
。
(5)由给予的信息,可知由1分子乙醛与3分子HCHO发生加成反应可以得到C(CH2OH)3CHO,然后与氢气发生加成反应得到C(CH2OH)4。
(1)①反应是卤代烃![]() 在NaOH水溶液中加热,水解生成
在NaOH水溶液中加热,水解生成![]() ;A为
;A为![]() ,A中官能团的名称是醛基;
,A中官能团的名称是醛基;
(2)A与X发生反应③得 ,由信息
,由信息 得X为
得X为 ,
, 经④在浓硫酸、加热条件下,发生消去反应生成
经④在浓硫酸、加热条件下,发生消去反应生成 ,方程式为
,方程式为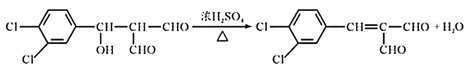 ;
;
(3)物质B为 与H2按照物质的量之比1:1加成得到物质T
与H2按照物质的量之比1:1加成得到物质T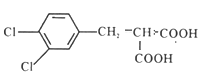 。T的同分异构体的结构特点:①属于芳香族化合物,含有苯环;②lmol该物质与足量碳酸氢钠溶液反应生成2 mol CO2,说明含有两个羧基;③核磁共振氢谱有2组吸收峰,其面积比为6:2,结构对称,符合下列条件的T的同分异构体的结构简式可能为:
。T的同分异构体的结构特点:①属于芳香族化合物,含有苯环;②lmol该物质与足量碳酸氢钠溶液反应生成2 mol CO2,说明含有两个羧基;③核磁共振氢谱有2组吸收峰,其面积比为6:2,结构对称,符合下列条件的T的同分异构体的结构简式可能为: 等。
等。
(4)以R″—CHO代表X,X与苯酚在一定条件下发生缩聚反应,形成高聚物的化学方程式 ;
;
(5))由给予的信息,可知由1分子乙醛与3分子HCHO发生加成反应可以得到C(CH2OH)3CHO,然后与氢气发生加成反应得到C(CH2OH)4.合成路线流程图为: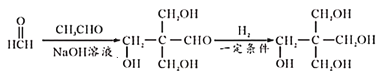


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 16O2和18O2互为同位素B. 红磷和白磷互为同素异形体
C. C3H8和C4H10互为同系物D. C2H5OH和CH3OCH3互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,下列说法错误的是
A.14g氮气含有NA个氮原子
B.标准状况下,22.4L H2O含有氢原子个数为2NA
C.20gD2O中所含的质子数为10NA
D.25℃、101kPa时,含NA个氢分子的气体样品体积大于22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢化钠(NaH)为白色晶体,其中H有很强的还原性,因此常用氢化钠在高温下将TiCl4 还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用单线桥标出电子转移的方向与数目_________________________;NaH能与水剧烈反应NaH+H2O═NaOH+H2↑,NaH与液氨(NH3)也有类似反应,写出反应的化学方程式___________________________
(2)配平反应方程式:___Al+___NaNO3+___H2O=___Al(OH)3+___N2↑+___NaAlO2
(3)实验室用MnO2和浓盐酸制氯气的反应为 MnO2+4HCl(浓) = MnCl2+2H2O+Cl2↑反应中,如果有17.4g纯MnO2被还原,那么被氧化的氯化氢的质量为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①有机化学反应因反应条件不同,可生成不同的有机产品。例如:

②苯的同系物与卤素单质混合,若在光照条件下,侧链烃基上的氢原子被卤素原子取代;若在催化剂作用下,苯环某些位置上的氢原子被卤素原子取代。工业上按下列路线合成结构简式为 的物质,该物质是一种香料。
的物质,该物质是一种香料。

请根据上述路线,回答下列问题:
(1)A的结构简式可能为______。
(2)反应④的反应条件为______,反应⑤的类型为______。
(3)反应⑥的化学方程式为(有机物写结构简式,并注明反应条件):______。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取将A直接转化为D的方法,其原因是______。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液不呈紫色;②苯环上的一溴代物有两种;③分子中有5种不同化学环境的氢。写出符合上述条件的物质可能的结构简式(只写一种):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(a、d)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法正确的是

A. 电极Y连接电源的正极,发生还原反应
B. I口排出的是混合碱,Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生
D. a左侧膜为阳离子交换膜,c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积的硫酸钠、硫酸镁、硫酸铁溶液分别加入足量的氯化钡溶液,产生相同质量的沉淀,则三种溶液的物质的量浓度之比为( )
A.1:1:3B.1:2:3C.3:3:1D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计实验探究乙烯与溴的加成反应。已知制取乙烯的化学方程式为:
CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(1)甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是______(填编号)。
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的气体,未必是乙烯 D.使溴水褪色的气体,就是乙烯
(2)乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。乙同学推测此乙烯中可能含有的一种杂质气体是___________,在验证过程中必须全部除去。乙烯与溴水发生反应的化学方程式是______________________________,
(3)设计实验验证乙烯与溴水的反应是加成反应而不是取代反应:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A. D原子的简化电子排布式为[Ar]3s23p4
B. B、C两元素的第一电离能大小关系为B>C
C. 用电子式表示AD2的形成过程为![]()
D. 由B60分子形成的晶体与A60相似,分子中总键能:B60>A60
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com