
| A、CuCl2[Cu Cl2溶液] |
| B、NaOH[NaOH溶液] |
| C、NaCl[HCl气体] |
| D、CuSO4[Cu(OH)2] |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、可以用Si3N4、Al2O3制作高温结构陶瓷制品 |
| B、雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶 |
| C、化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础 |
| D、据测定,许多反应的温度每升高10K,其反应速率增加2~4倍.在实验室或工业生产中,常采用加热的方法使化学反应在较高的温度下进行,以提高反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:

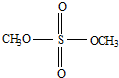 是一种酯类物质,回答下列问题:
是一种酯类物质,回答下列问题: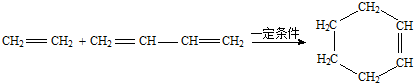 ,Ⅱ有两种同分异构体在一定条件下可相互反应生成
,Ⅱ有两种同分异构体在一定条件下可相互反应生成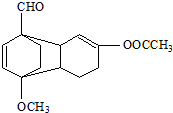 ,这两种同分异构体的结构简式分别为
,这两种同分异构体的结构简式分别为
查看答案和解析>>
科目:高中化学 来源: 题型:
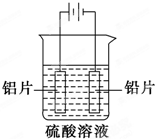 铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30min,即可得到更加致密的氧化膜.下列有关说法正确的是( )
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜.某研究性学习小组模拟工业法对铝片表面进行氧化处理.分别以铅片、铝片为电极,以硫酸溶液为电解液,按照如图所示装置连接电解池装置,电解40min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30min,即可得到更加致密的氧化膜.下列有关说法正确的是( )| A、电解时电子从电源负极→导线→铝极,铅极→导线→电源正级 |
| B、在电解过程中,H+向阳极移动,SO42-向阴极移动 |
| C、电解过程阳极周围溶液的pH下降 |
| D、电解的总反应为2Al+6H+═2Al3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 所含杂质 | 除去杂质的试剂或方法 | |
| A | KNO3溶液 | KOH | H滴入稀HNO3的同时用pH试纸测定至溶液呈中性 |
| B | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| C | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| D | NaNO3 | CaCO3 | 加稀盐酸溶液、过滤、蒸发、结晶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4(HCl):AgNO3溶液、过滤 |
| B、KNO3(K2SO4):Ba(NO3)2溶液、过滤 |
| C、Cu(CuO):盐酸、过滤 |
| D、CaCO3(CaO):水、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①>②>④>③ |
| B、①>②>③>④ |
| C、④>①>③>② |
| D、④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
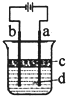 由于Fe(OH)2 极易被氧化;所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用图所示实验装置则可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2 极易被氧化;所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用图所示实验装置则可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com