
| A. | CH3COOH | B. | (NH4)2Fe (SO4)2 | C. | NaHCO3 | D. | NaHSO4 |
分析 由于只有含弱离子的盐才能水解,且强酸弱碱盐水解显酸性,强碱弱酸盐水解显碱性,故物质若因水解而呈酸性,则此物质应为强酸弱碱盐,据此分析.
解答 解:A、CH3COOH是酸,不能水解,是由于电离出氢离子而使溶液显酸性,故A错误;
B、(NH4)2Fe (SO4)2是强酸弱碱盐,水解显酸性,故B正确;
C、NaHCO3是强碱弱酸盐,水解后溶液呈碱性,故C错误;
D、NaHSO4是强酸强碱的酸式盐,不能水解,是在水溶液中直接电离出H+,使溶液呈酸性,而不是由于水解,故D错误;
故选B.
点评 本题考查了溶液显酸性的原因以及盐类水解的规律,应注意的是溶液显酸性不一定是酸溶液,还可能是盐溶液.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠投入水中立即熔化成闪亮的小球,说明反应放热且钠的熔点低 | |
| B. | 钠在空气中燃烧生成淡黄色的Na2O2 | |
| C. | 金属钠可以将铜从其盐溶液中置换出来 | |
| D. | 实验后剩余的钠块能放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
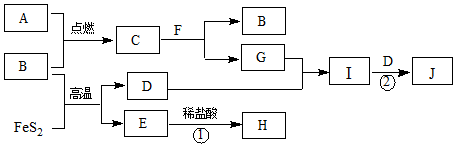
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NH3•H2O溶液做导电性实验,灯泡很暗,说明NH3•H2O是弱电解质 | |
| B. | 等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB | |
| C. | 常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA?的电离程度大于其水解程度 | |
| D. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、玻璃、陶瓷都是传统的硅酸盐工业产品 | |
| B. | 高纯度的硅是制半导体的重要材料 | |
| C. | 自然界中硅单质的含量居各元素的第二位 | |
| D. | 二氧化硅可用于做光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白 | |
| B. | CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒 | |
| C. | 氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面 | |
| D. | 氯元素有毒,禁止放入口中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com