
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为( )(不考虑盐酸的挥发)
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
科目:高中化学 来源:2015届福建省高三上学期第二次质量检查化学试卷(解析版) 题型:填空题
(14分)亚铁氰化钾(K4Fe(CN)6 ,黄血盐)在实验室、电镀、食品添加剂及医学上可用于冶疗铊(Tl)中毒、烧制青花瓷时可用于绘画等有广泛用途。已知HCN是一种极弱的酸。现有一种用含NaCN废水合成黄血盐的主要工艺流程如下:

(1)实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于 溶液,再用蒸馏水稀释,NaCN水解的离子方程式为_________。
(2)实验室K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6],生成的盐又可用于治疗Tl2SO4中毒,试写出上述检验Fe3+反应的离子方程式为 。
(3)流程图中加入碳酸钠溶液主要目的是 。
(4)相同温度下溶解度:Na4[Fe(CN)6] K4[Fe(CN)6](选填:“>”、“=”、“<”)。
(5)长期火炒添加有亚铁氰化钾的食盐,这时会发生分解反应,试配平下列方程式:3K4Fe(CN)6=□KCN+□Fe3C+□C+□(CN)2↑+□N2↑
(6)电镀银时,电镀液不能直接用硝酸银溶液,可将其转变为K4[Ag2 (CN)6],写出AgCl与黄血盐制取电镀液的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:填空题
(14分)
(1)与OH-电子数和质子数均相同的单核微粒的离子结构示意图为____________
(2)250C时,2.3 g酒精在血液中被氧气完全氧化放出66.8 kJ热量,该反应的热化学方程式为________________(3)汽车安全气囊中含MYn和红棕色金属氧化 物。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化。

①写出元素符号:M______;Y_______.
②在2L密闭容器中,起始投入2 mol Y2和3.5 mol H2发生反应II,测得平衡时的数据如表。

若该反应ΔH <0,则T1______T2(填“ >”、“ <”或“=”);在温度T2下,若经过10 min反应达到平衡,则平均速率v(YH3)= ______,平衡常数为______ (保留两位有效数字)
③反应III的化学方程式 为___________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
将0.5 mol Na和0.5 mol Mg分别投入到过量的m1 g水和m2 g盐酸中,分别得到溶液a和b,若m1 = m2,则a和b的质量关系是 ( )
A.a>b B.a<b C.a=b D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A. 1︰1 B. 2︰1 C. 1︰2 D. 2︰3
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是( )
A.CO2通入饱和Na2CO3溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
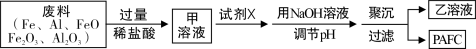
下列判断无法确定的是
A.PAFC因水解而能净水
B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性
D.乙溶液肯定不可能呈强碱性
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪一中高三上学期期中联考化学试卷(解析版) 题型:选择题
下列条件下,两瓶气体所含原子数、分子数一定相等的是
A.同温度、同体积的N2和CO B.同密度、同体积的H2和N2
C.同温度、同压强的C2H4和C3H6 D.同质量、不同密度的N2O和CO2
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
已知:N2(g)+3H2(g) 2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
2NH3(l) △H= -132 kJ/mol,蒸发1mol NH3(l)需要吸收的能量为20kJ,相关数据如下
| H2(g) | N2(g) | NH3(g) |
1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
一定条件下,在体积1L的密闭容器中加入1molN2(g)和3molH2(g)充分反应,生成NH3(g)放出热量QkJ,
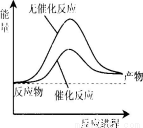
下列说法正确的是
A.上图可表示合成氨过程中的能量变化
B.a的数值为1173
C.Q的数值为92
D.其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com