
分析 (1)A、生成N2,N元素化合价升高,生成SO2,S元素化合价降低,符合氧化还原反应原理,预测合理;B、生成NH3、SO3、H2O,为非氧化还原反应,预测合理;C、生成SO2,S元素化合价降低,无元素化合价升高,不符合氧化还原反应原理,预测不合理;D、既有元素化合价升高,也有元素化合价降低,预测合理.
(2)①利用加热气体膨胀的原理检验装置的气密性,设计实验过程;
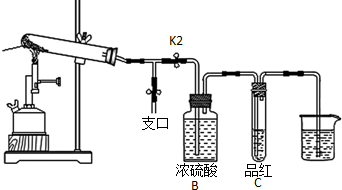
②用浓盐酸检验NH3,打开K1,用蘸有浓盐酸的玻璃棒靠近支口,若出现白烟,证明含有NH3,但不能用润湿的石蕊试纸,因为混合气体中含有SO2,SO3,试纸不可能变蓝;装置A与B之间的T型导管中出现白色固体可能是SO2与NH3反应生成的(NH4)2SO3,或SO3与NH3反应生成的(NH4)2SO4,或SO3固体,或酸式盐及以上物质的混合物.
③A试管中残留的白色固体是两性氧化物,则A为Al2O3,与NaOH溶液反应生成偏铝酸钠和水;
(3)根据氧化还原反应中化合价升高的总价数与降低的总价数相等,结合相同条件下气体物质的量之比等于体积之比得到
解答 解:(1)A、生成N2,N元素化合价升高,生成SO2,S元素化合价降低,符合氧化还原反应原理,预测合理,故A正确;
B、生成NH3、SO3、H2O,为非氧化还原反应,预测合理,故B正确;
C、生成SO2,S元素化合价降低,无元素化合价升高,不符合氧化还原反应原理,预测不合理,故C错误;
D、既有元素化合价升高,也有元素化合价降低,预测合理,故D正确;
故答案为:C;
(2)①利用加热气体膨胀的原理检验装置的气密性,首先要关闭支口开关K1并打开K2,然后将最后的导管通入水中,微热大试管,若看到从导管中出现气泡,且停止加热后在导管中上升一段水柱,则证明气密性好;
故答案为:关闭支口开关K1并打开K2,将最后的导管通入水中,微热大试管,若看到从导管中出现气泡,且停止加热后在导管中上升一段水柱,则证明气密性好好;
②用浓盐酸检验NH3,打开K1,用蘸有浓盐酸的玻璃棒靠近支口,若出现白烟,证明含有NH3,但不能用润湿的石蕊试纸,因为混合气体中含有SO2,SO3,试纸不可能变蓝;装置A与B之间的T型导管中出现白色固体可能是SO2与NH3反应生成的(NH4)2SO3,或SO3与NH3反应生成的(NH4)2SO4,或SO3固体,或酸式盐及以上物质的混合物;
故答案为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,若出现白烟或用润湿的红色石蕊试纸变蓝检验;(NH4)2SO4或者(NH4)2SO3或者SO3或酸式盐及以上物质的混合物;
③A试管中残留的白色固体是两性氧化物,则A为Al2O3,与NaOH溶液反应生成偏铝酸钠和水,其反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)根据氧化还原反应中化合价升高的总价数与降低的总价数相等,可得:6n(N2)=2n(SO2),可得 n(N2):n(SO2)=1:3,相同条件下气体物质的量之比等于体积之比,所以V(N2):V(SO2)=1:3,
故答案为:1:3.
点评 本题考查探究物质组成的实验方案设计与分析、氧化还原反应原理及计算、基本操作、离子方程式的书写等,侧重于考查学生的实验探究能力和对基础知识的综合应用能力,注意物质性质的理解应用,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 要清洗附着在试管壁上的硫,可用的试剂是CS2 | |
| B. | 硫化亚铁溶于稀硝酸中反应的化学方程式为:FeS+2HNO3→Fe(NO3)2+H2S↑ | |
| C. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 | |
| D. | 在Na2SO3和BaCO3混合物中加入过量的稀硫酸,能产生气泡并有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N5+共有34个核外电子 | B. | N5+中氮原子间以共价键结合 | ||
| C. | 化合物N5ASF6中AS的化合价为+1价 | D. | 化合物N5ASF6中F的化合价为-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物含碳.氢.氧三种元素 | |
| B. | 该化合物是乙烷 | |
| C. | 该化合物分子中碳.氢原子个数之比是2:3 | |
| D. | 该有机物含2个碳原子,6个氢原子,但不能确定是否含氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.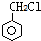 的属于芳香族化合物的同分异构体有3种.
的属于芳香族化合物的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解 | |
| B. | 先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀 | |
| C. | 先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com