
 甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知
甲醇(CH3OH)是一种重要的化工原料,广泛应用于化工生产,也可以直接用做燃料.已知分析 (1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态,根据盖斯定律结合热化学方程式的书写来回答;
(2)化学计量数与反应热成正比,根据热化学方程式的以及来计算回答;
(3)燃料电池中,负极是燃料发生失电子的氧化反应,根据电解质环境书写电极反应;
(4)A、A端做阳极是铁,B端析出氢气可驱赶原溶液中溶解的少量氧气;
B.阳极上铁失电子得到亚铁离子,阴极上氢离子放电,所以可以电解质溶液可以选取氯化钠溶液;
C.阳极应该用铁电极,阴极用惰性电极亦可;
D.阴极上得电子生成氢气.
若将所得Fe(OH)2沉淀暴露在空气中,会被氧化为氢氧化铁沉淀.
解答 解:(1)已知:①CH3OH(1)+O2(g)=CO(g)+2H2O(g);△Ha=-443.64kJ•mol-1
②2CO(g)+O2(g)=2CO2(g);△Hb=-566.0kJ•mol-1
反应①×2+②得到2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=2(-443.64kJ•mol-1)+(-566.0kJ•mol-1)=-1453.8 kJ•mol-1,故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.8 kJ•mol-1;
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.8 kJ•mol-1;
(2)根据反应:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1453.8 kJ•mol-1;完全燃烧64g甲醇释放出的热量是1453.8kJ,生成二氧化碳是2mol,完全燃烧20g甲醇,生成二氧化碳和水蒸汽时,放出的热量为$\frac{1453.8×20}{64}$kJ=454.15kJ,生成的CO2气体标准状况下体积是$\frac{2×20}{64}×22.4$L=14L,故答案为:454.15;14;
(3)在甲醇燃料电池中,负极是燃料甲醇发生失电子的氧化反应,在碱性环境下,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:负;CH3OH-6e-+8OH-=CO32-+6H2O;
(4)A、因为生成的氢气将装置中原有氧气带出,且氢气的密度小于水,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,所以“a”为正极,“b”为负极,故A正确;
B、因为阳极是铁,活泼电极作阳极时,阳极材料铁失电子生成亚铁离子,阴极上氢离子放电,生成氢气,所以能生成氢氧化亚铁白色沉淀,则电解液选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,阴极上水得电子生成氢气和氢氧根离子,氢气能防止氢氧化亚铁被氧化而导致实验失败,所以电极反应式为:2H2O+2e-═H2↑+2OH-,故D正确;故选:ABD;若将所得Fe(OH)2沉淀暴露在空气中,会被氧化为氢氧化铁沉淀现象是白色沉淀迅速变为灰绿色,最终变为红褐色,方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:ABD;白色沉淀迅速变为灰绿色,最终变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查了热化学方程式的书写方法、盖斯定律的应用以及燃料电池的工作原理知识,属于综合知识的考查,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | Cl原子的结构示意图: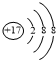 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | NH4Cl的电子式: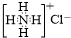 | D. | 间硝基甲苯的结构简式: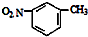 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸不能盛放在玻璃试剂瓶中 | |
| B. | 由沙子制备光伏材料时的反应之一为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑ | |
| C. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 | |
| D. | 玻璃、水晶、陶瓷的主要成分均是硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
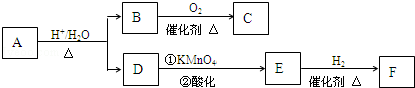
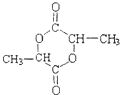 .
.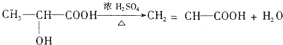 .
.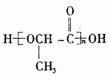 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量大于生成物的总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算出某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
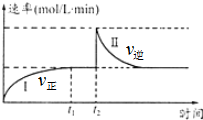 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com