
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )
A. NH4HCO3和盐酸的反应是放热反应
B.该反应中,热能转化为产物内部的能量
C.反应物的总能量高于生成物的总能量
D.反应的热化学方程式为:NH4HCO3+HCl===NH4Cl+CO2↑+H2O ΔH=+Q
科目:高中化学 来源: 题型:
下列说法中错误的是
( )
①化学性质相似的物质是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④分子中含有碳、氢元素的化合物是烃类
A.①②③④ B.只有②③
C.只有③④ D.只有①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择
| 阳离子 | K+ 、Na+ 、Fe2+ 、Ba2+、NH |
| 阴离子 | OH-、NO |
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①B的化学式为_________________________________________________________。
②A、B溶液混合后加热呈中性,反应的离子方程式为
________________________________________________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为___________________________________________________________。
②经分析上述过程中溶液变黄的原因可能有两种:
Ⅰ.________________________________________________________________________。
Ⅱ.________________________________________________________________________。
③请用一简易方法证明上述溶液变黄的原因__________________________________。
④利用溶液变黄原理,将其设计成原电池,若电子由a流向b,则b极的电极反应式为
______________________________________________________________________ __
__
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在周期表主族元素中,甲元素与乙、丙、丁三元素紧密相邻(上下或左右),甲、乙两元素的原子序数之和等于丙元素的原子序数,这四种元素原子的最外层电子数之和为20。下列说法正确的是( )
A.甲、乙、丙、丁四种元素均为短周期元素
B.气态氢化物的稳定性:甲>乙
C.最高价氧化物对应的水化物的酸性:甲<丙
D.元素丁与乙形成的化合物中可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置__________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)______。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________________________________________________________________________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊 接钢轨,请写出反应的化学方程式:________________________________________________________________________。
接钢轨,请写出反应的化学方程式:________________________________________________________________________。
若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________ ___________________________________________________
___________________________________________________
_________________________________ _______________________________________。
_______________________________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_____________________________________________________________________________
_______________ _________________________________________________________。
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用系统命名法命名下列烷烃
(1) 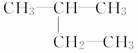 ______________________________________________;
______________________________________________;
(2) 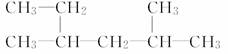 ___________________________________;
___________________________________;
(3) 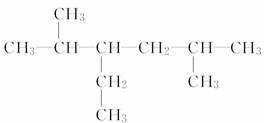 _______________________________;
_______________________________;
(4) 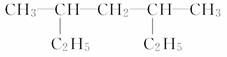 ___________________________________;
___________________________________;
(5) 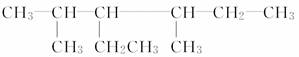 __________________________。
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求回答下列问题:
(1) 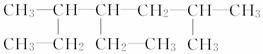 的名称为____________________。
的名称为____________________。
(2)A、B、C三种烃的化学式均为C6H10,它们的分子中均无支链或侧链。
①若A为环状,则其结构简式为________________。
②若B为含有双键的链状结构,且分子中不存在“ ”基团,则其可能的结构简式为________________________________(任写一种)。
”基团,则其可能的结构简式为________________________________(任写一种)。
③若C为含有三键的链状结构,则其可能的结构简式及名称为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
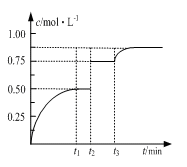
一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g) xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。下列说法正确的是( )
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。下列说法正确的是( )
A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质Q
D.t1~t3间该反应的平衡常数均为4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com