
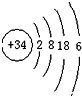
 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;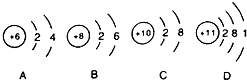
分析 (1)红宝石的主要成分为氧化铝,Cr的离子带3个单位正电荷,金刚石为C;
(2)①人体亚铁离子少,出现贫血;
②C30H26O12中含C、H、O元素;
③电子层数=周期数;
④原子结构中最外层电子数相同的化学性质相似.
解答 解:(1)红宝石它是刚玉的一种,它的主要成分为Al2O3,因含微量带3个单位正电的铬(Cr )离子Cr3+而成红至紫红色,其硬度仅次于C(金刚石),
故答案为:Al2O3;Cr3+;C;
(2)①人体亚铁离子少,出现贫血,则人体因摄入铁元素(或铁)不足而出现贫血现象,故答案为:铁元素(或铁);
②C30H26O12中含C、H、O元素,共三种元素,故答案为:三;
③电子层数=周期数,则由 推测硒在元素周期表中第四周期,故答案为:四;
推测硒在元素周期表中第四周期,故答案为:四;
④原子结构中最外层电子数相同的化学性质相似,只有B中最外层电子数为6,故答案为:B.
点评 本题考查较综合,涉及物质组成和性质、原子结构与元素周期表等,注重高频考点的考查,把握物质的组成、元素周期表和原子结构为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:实验题
 .
. .
. .
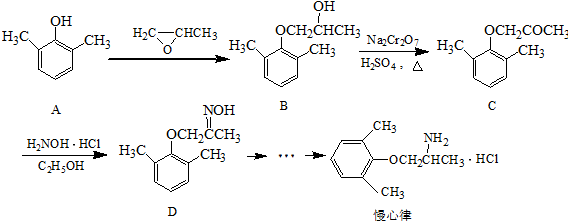
. ).写出以邻甲基苯酚(
).写出以邻甲基苯酚(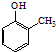 )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、SCN-可以大量共存 | |
| B. | 通入H2S气体至过量会生成两种沉淀 | |
| C. | 加入NaOH溶液至Fe3+刚好沉淀完全的离子方程式:NH4++Fe3++4OH-═Fe(OH)3↓+NH3•H2O | |
| D. | 离子浓度关系:c(SO42-)>c(NH4+)>c(Fe3+ )>c(H+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中氧元素的化合价是-2 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 16S的结构示意图: | D. | 甲烷的结构式为: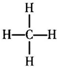 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
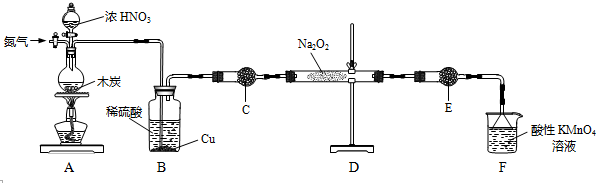
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
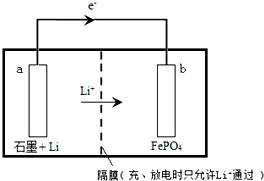 LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.
LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | H2O2能清除路面空气中的CxHy、CO等,其主要是利用了H2O2的还原性 | |
| C. | 采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com