
| A�������£������ȡ�pH=3������ʹ��ᣬ�к�NaOH��Һ������������С�ڴ��� | ||
B��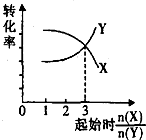 ��һ�������£���X��Y�������ʰ���ͬ�ı��������ܱ������з�Ӧ����Z��ƽ�����X��Y��ת����������ʼʱ�����ʵ����ʵ���֮��
| ||
C��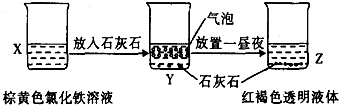 ijͬѧ��ʵ���ҽ�������ͼ��ʾ��ʵ�飬��Y�з�Ӧ�����ӷ���ʽΪ3CaCO3+2Fe3++3H2O=2Fe��OH��3+3CO2��+3Ca2+ | ||
D����25��ʱ����amo1?L-l�İ�ˮ��0.01 moI?L-1������������ϣ���Ӧ��ȫʱ��Һ��c��NH4+��=c��C1-�����ú�a�Ĵ���ʽ��ʾ��Ӧ��ȫʱNH3?H2O�ĵ��볣��Kb=
|
| n(X) |
| n(Y) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| n(X) |
| n(Y) |
| c(NH4+)?c(OH-) |
| c(NH3?H2O) |
| 0.005��1��10-7 | ||
|
| 10-9 |
| a-0.01 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���úϽ���nCu��nMg=2��1 |
| B���Ͻ���ȫ�ܽ�ʱ����Һ��C��H+��=8mol/L�����Է�Ӧǰ����Һ����仯�� |
| C��NO2��N2O4�Ļ�������У�NO2�����������80% |
| D���õ�2.54g����ʱ������NaOH��Һ�������600mL�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� ����е����ϴ�Ļ���Һ������ |
B�� �ⶨ��ѧ��Ӧ���� |
C��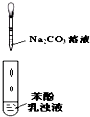 �Ƚϱ��ӡ�̼�������ǿ�� |
D��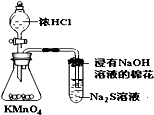 �Ƚ�KMnO4��Cl2��S�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʹ���ȱ�����Һ�У�Na+��K+��AlO2-��SO42- | ||
B��
| ||
| C������Al�ܷų�H2 ����Һ�У�Br-��HSO3 -��SO42-��Fe2+ | ||
| D����ˮ�������c��OH-��=10-11mol?L-1 ����Һ�У�Na+��K+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A�����ʱ��ʯī������������������� |
| B�����ʱ�������缫��Ӧʽ��I--6e-+3H2O=IO3-+6H+ |
| C������������ת��3 mol e-ʱ�������Ͽ��Ƶ�KIO3 107 g |
| D�����һ��ʱ��������Һ��pH��С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢� | B���ڢ� | C���٢� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| x |
| 3 |
| x |
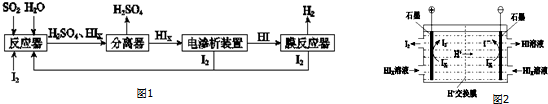
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2012 �껷���ȴʡ�PM2.5����ָ������ֱ��С�ڻ����2.5 �ף�1 ��=1��10-6 �ף��Ŀ�������PM2.5��������γɵķ�ɢϵ���ڽ��� |
| B��ʯīϩ��һ�ִ�ʯī�������á�˺�ѡ�����������ĵ���̼ԭ������ϣ������ַ�����C60�����ʯ���л�á�ֻ��һ��̼ԭ�Ӻ��̼��Ƭ��Ҳ�ؽ���Ϊ�о����� |
| C���κ�Ԫ�ص�ԭ�Ӷ����ɺ�����Ӻͺ������ӡ�������ɵ� |
| D���������ͳ�Ʒ����������о���ʵ�鷽����ģ�ͻ��������ǻ�ѧ�о��ij��÷��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������ | B��Ԫ�� | C������ | D��ԭ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com