
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
| A. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ/mol | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ/mol | |
| C. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=+91.5kJ/mol | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol |
分析 焓变等于断键吸收的能量减去成键释放的能量,且物质的量与热量成正比,互为逆反应时的焓变数值相同、符号相反,以此来解答.
解答 解:由表格中的数据可知,H2(g)+Cl2(g)═2HCl(g)△H=(436kJ/mol)+(243kJ/mol)-(431kJ/mol)×2=-183kJ/mol,
由物质的量与热量成正比可知$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H=-91.5kJ/mol,
由互为逆反应时的焓变数值相同、符号相反可知2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ/mol,
故选C.
点评 本题考查热化学方程式,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与计算能力的考查,注意燃烧反应为放热反应,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的平均反应速率为0.15mol•L-1•min-1 | |
| B. | 恒温下达到平衡的标志是C和A的生成速率相等 | |
| C. | 降低平衡体系的温度,逆反应速率变小,正反应速率增大 | |
| D. | B的转化率为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
| 沸点/℃ | 178 | 205 | 249 | 80 |
| 熔点/℃ | 26 | -15 | 122 | 5.5 |
| 苯甲酸在水中的溶解度 | ||
| 17℃ | 25℃ | 100℃ |
| 0.21g | 0.34g | 5.9g |


查看答案和解析>>
科目:高中化学 来源: 题型:推断题
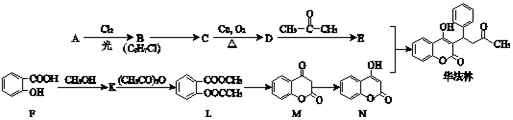
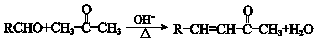
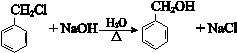 .
.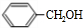 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2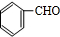 +2H2O.
+2H2O.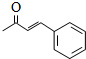 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠、碳酸氢钠 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
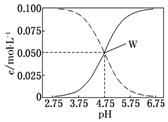 常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )
常温下,醋酸、醋酸钠混合溶液中,已知c(CH3COOH)+c(CH3COO-)=0.1mol•L-1,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列有关溶液中离子浓度关系的说法正确的是( )| A. | pH=5.75的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | pH=7,c(Na+)=0.1 mol•L-1,c( CH3COOH)>c(Na+)=c( CH3COO-)>c(H+)=c(OH-) | |
| C. | pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1 mol•L-1 | |
| D. | 向W点所表示的1.0 L溶液中通入0.05 mol HCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质均属于营养物质 | B. | 甲烷、乙醇、葡萄糖均属于有机物 | ||
| C. | NaOH与H2SO4均属于电解质 | D. | 纯碱、烧碱均属于碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com