
 将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,下列说法中错误的是( )| A. | OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3- | |
| B. | A点溶液中的溶质为NaCl、NaHCO3 | |
| C. | 混合物中NaOH的质量0.60 g | |
| D. | 当加入35 mL盐酸时,产生CO2的体积为224 mL |
分析 A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-;
B、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,所以A点的溶质为NaC1、NaHCO3;
C、根据AB段求出二氧化碳的物质的量,然后根据碳守恒求出碳酸钠的质量,最后根据总质量求氢氧化钠的质量;
D、AB段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式来求解.
解答 解:A、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,故A正确;
B、OA段发生反应的离子方程式为:H++OH-═H2O CO32-+H+═HCO3-,所以A点的溶质为NaC1、NaHCO3,故B正确;
C、由反应HCO3-+H+=H2O+CO2↑,n(CO2)=n(Na2CO3)=(45-25)×10-3×1=0.02mol,所以氢氧化钠的质量为2.32g-0.02×106g=0.2g,故C错误;
D、AB段发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,根据方程式n(CO2)=(35-25)×10-3L×1mol/L=0.01mol,所以二氧化碳的体积为:0.01mol×22.4L/mol=224mL,故D正确;
故选C.
点评 本题考查混合物计算,理解判断各阶段发生的反应是关键,侧重学生分析判断和计算能力的考查,难度中等.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
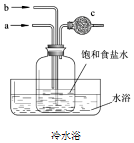
| A. | 先从b管通入NH3再从a管通入CO2 | B. | 先从a管通入CO2再从b管通入NH3 | ||
| C. | 广口瓶内有白色沉淀析出 | D. | c中试剂为碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
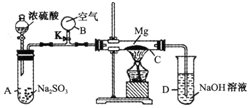 按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.
按如图装置进行如下实验,请用你所学知识完成下题:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发生耀眼白光,产生白烟,管壁上附有淡黄色物质.实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 | |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KClO3 | 浓盐酸 | Cl2 | ||
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 氧化性强弱的比较:KClO3<Cl2 | |
| B. | 第②组事实可以推测:ClO-、Cl-不能在溶液中大量共存 | |
| C. | 第①组的反应,当Cl2与FeBr2物质的量之比≤1:2时,只有一种元素被氧化 | |
| D. | 第③组反应的离子方程式为:2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 春节期间燃放的焰火的颜色是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| C. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com