
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图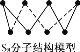 )含S—S键数目为7NA
)含S—S键数目为7NA
【答案】D
【解析】
A. 每个D2O分子含有10个质子、10个电子,2.0 g D2O物质的量n = ![]() =0.1mol。
=0.1mol。
B. 乙烯和丁烯的最简式为CH2,计算7 g CH2中所含的氢原子数目即可。
C. 2L 0.05 mol·L-1 NH4NO3溶液中所含NH4NO3的物质的量为0.1mol,0.1molNH4NO3溶液中氮原子的物质的量为0.2mol,氮原子数目是0.2NA。
D. 每个S8分子中含8个S—S键,256 g S8中n(S8)=![]() =1mol。
=1mol。
A.每个D2O分子含有10个质子、10个电子,2.0 g D2O物质的量为0.1mol,含有的质子数、电子数均为NA,A正确。
B. 乙烯和丁烯的最简式相同,均为CH2,7 g乙烯和丁烯的混合气体中所含的氢原子数目,可通过计算7 g CH2中所含的氢原子数目n(H)=![]() ×2=1mol,氢原子数目为NA,B正确。
×2=1mol,氢原子数目为NA,B正确。
C.室温下,2L 0.05 mol·L-1 NH4NO3溶液中所含NH4NO3的物质的量为0.1mol,0.1molNH4NO3溶液中氮原子的物质的量为0.2mol,氮原子数目是0.2NA,C正确。
D.每个S8分子中含8个S—S键,256 g S8中n(S8)=![]() =1mol,1mol S8含S—S键数目为8NA,D错误。
=1mol,1mol S8含S—S键数目为8NA,D错误。


科目:高中化学 来源: 题型:
【题目】在绝热恒容密闭容器一定条件下使反应2A(g)+B(s)![]() 3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
3C(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
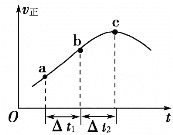
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应ΔH>0
D.Δt1=Δt2时,a~b段消耗A的量小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是化学中常用的思维方法。下列推理正确的是![]()
A.HF是卤族元素的氢化物中沸点最高的,因为HF分子间存在氢键,所以![]() 也是同族元素氢化物中沸点最高的
也是同族元素氢化物中沸点最高的
B.NaCl与浓硫酸加热可制得HCl,推测NaI与浓硫酸加热可制得HI
C.因为AgCl、AgBr、AgI均难溶,推测AgF也难溶于水
D.由于还原性![]() ,推测还原性
,推测还原性![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如右图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是
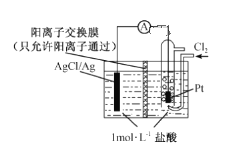
A.正极反应AgCl +e-= Ag+Cl-
B.正极反应Cl2 +2e- +2Ag+=2AgCl
C.放电时右侧盐酸的浓度变大
D.当电路中转移0.01 mol e-时,析出沉淀1.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.可以根据![]() 和AgCl的Ksp的大小比较两者的溶解能力
和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的![]() 与NaHS溶液相比,NaHS溶液的pH大
与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的![]() 溶液和
溶液和![]() 溶液,后者的
溶液,后者的![]() 大
大
D.能使碘化钾淀粉试纸变蓝的溶液中,![]() 、
、![]() 、
、![]() 、
、![]() 等离子可以大量共存
等离子可以大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成![]() 气态分子,其立体结构呈三角锥形.
气态分子,其立体结构呈三角锥形.![]() 在气态和液态时,分子结构如图所示,下列关于
在气态和液态时,分子结构如图所示,下列关于![]() 分子的说法中不正确的是
分子的说法中不正确的是![]()
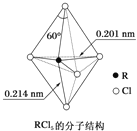
A.分子中5个![]() 键键能不都相同
键键能不都相同
B.键角![]() 有
有![]() 、
、![]() 、
、![]() 几种
几种
C.![]() 受热后会分解生成分子立体结构呈三角锥形的
受热后会分解生成分子立体结构呈三角锥形的![]()
D.每个原子都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素或者化合物性质的比较中,正确的是![]()
![]()
A. 结构相似的分子晶体的熔沸点,与相对分子质量呈正相关,所以![]()
B. Na、Mg、Al原子最外层电子数依次增多,原子半径也依次增大
C. 在分子中,两个原子间的键长越长,键能越大
D. 一般而言,晶格能越高,离子晶体的熔点越高、硬度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_______________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)。
__________________________________________
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为_______________。其中氮元素原子最外层电子排布的轨道表达式是_________________________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是____________。CS2熔点高于CO2,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法不正确的( )

A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应物浓度减小引起的
D.图中阴影“面积”可以表示t1-t2时间内c(ClO3-)的减少量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com