
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 ①10毫升的量筒量的最小读数为0.1mL;
②托盘天平的最小读数为0.1g;
③滴定管的最小读数为0.01mL;
④广泛pH试纸测得某溶液的pH只能为整数,不会读出小数.
解答 解:①由于量筒的最小读数为0.1mL,所以无法用10毫升的量筒量取7.60mL的液体,故①错误;
②托盘天平的最小读数可以为0.1g,可用托盘天平称取22.5g KCl,故②正确;
③酸式滴定管和碱式滴定管的最小读数为0.01mL,所以酸碱中和滴定时,消耗0.100 0mol•L-1的盐酸的体积可以为23.25mL,故③正确;
④广泛pH试纸测定的数值只能为整数,无法测得某溶液的pH=4.4,故④错误;
故选D.
点评 本题考查了常见仪器的构造及使用方法,题目难度不大,明确常见仪器的构造及使用方法为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 点燃爆竹后,硫燃烧生成SO3 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHCl3是三角锥形 | B. | AB2是V形,其A可能为sp2杂化 | ||
| C. | 二氧化硅是sp杂化,是非极性分子 | D. | NH4+是平面四边形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物沸点:HI>HBr>HCl>HF | B. | 离子还原性:I->Br->Cl->F- | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 粒子半径:Al3+<Mg2+<F- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
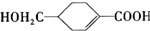 的合成路线如图所示.回答下列问题:
的合成路线如图所示.回答下列问题: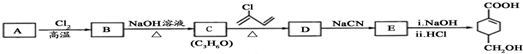
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$
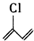 的名称为2-氯-1,3-丁二烯,该有机物分子中最多有10个原子共平面.
的名称为2-氯-1,3-丁二烯,该有机物分子中最多有10个原子共平面.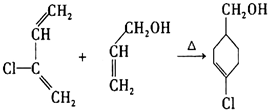 .
.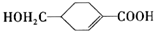 满足下列条件的同分异构体共有6种.
满足下列条件的同分异构体共有6种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的酸性强于次氯酸,判断硫与氯的非金属性强弱 | |
| B. | 镁与铝分别与物质的量浓度相同的盐酸反应,判断镁与铝的金属活动性强弱 | |
| C. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| D. | Cl2与Br2分别与足量的H2反应,判断氯与溴的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气和天然气的主要成分都是甲烷 | |
| B. | 石油经过分馏及裂化等工序得到的物质均为纯净物 | |
| C. | 石油的裂解是化学变化,而石油的分馏和煤的干馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可用先干馏后分馏的方法得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com