
| A. | 用铁片和稀硫酸反应制氢气时,可改用98%的浓硫酸加快生成氢气速率 | |
| B. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| D. | SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
分析 对于化学反应,增大浓度、升高温度、加入催化剂以及增大固体的表面积可增大反应速率,结合选项中所给信息解答该题.
解答 解:A.浓硫酸具有强氧化性,与锌反应生成二氧化硫气体,而不生成氢气,故A错误;
B.加入氯化钠溶液,溶液体积增大,氢离子浓度减小,则反应速率减小,故B错误;
C.减小压强,活化分子百分数不变,但是压强减小,反应速率减小,故C正确;
D.升高温度对反应速率的影响是增多单位体积内活化分子数增多,正逆反应速率都增大,故D错误;
故选C.
点评 本题考查化学反应速率的影响,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加热灼烧海带时要在蒸发皿中进行 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液一定含有Cl- | |
| D. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X->Y- | |
| B. | 在X-、Y-、Z-、W- 中 Z- 的还原性最强 | |
| C. | 氧化性:Z2>W2 | |
| D. | 反应2Z-+Y2=2Y-+Z2可以发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
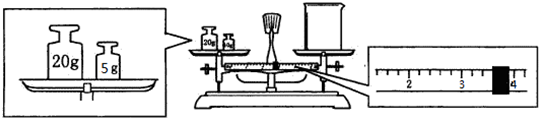
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
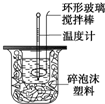 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净物②③⑥ | B. | 混合物①③④ | C. | 电解质②⑥ | D. | 非电解质④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com