
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
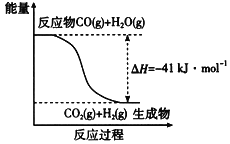
反应的热化学方程式为____________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJmol1,H—H键的键能是436.0 kJmol1,N—H键的键能是391.55 kJmol1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=_____________________。
NH3(g) ΔH=_____________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g) ![]() CO2(g) ΔH1=393.5 kJmol1;②2H2(g)+O2(g)
CO2(g) ΔH1=393.5 kJmol1;②2H2(g)+O2(g) ![]() 2H2O(l) ΔH2=571.6 kJmol1;③2C2H2(g)+5O2(g)
2H2O(l) ΔH2=571.6 kJmol1;③2C2H2(g)+5O2(g) ![]() 4CO2(g)+2H2O(l)ΔH3=2599 kJmol1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
4CO2(g)+2H2O(l)ΔH3=2599 kJmol1。298 K时反应2C(s,石墨)+H2(g)C2H2(g)的焓变:ΔH=_____________________。
(4)已知:铝热反应是放热反应,又知,常温下: 4Al(s)+3O2(g) ![]() 2Al2O3(s) ΔH1;4Fe(s)+3O2(g)
2Al2O3(s) ΔH1;4Fe(s)+3O2(g) ![]() 2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
2Fe2O3(s) ΔH2。下面关于ΔH1、ΔH2的比较正确的是________。
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
【答案】CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=41 kJ mol146.2 kJ mol1226.7 kJ mol1B
【解析】
(1)由图知,CO(g)+H2O(g) ![]() CO2(g)+ H2(g) ΔH=41 kJ mol1。
CO2(g)+ H2(g) ΔH=41 kJ mol1。
(2)![]()
![]() N2(g)+
N2(g)+![]()
![]() H2(g)
H2(g)![]() NH3(g) ΔH=(948.9×
NH3(g) ΔH=(948.9×![]()
![]() + 436.0×
+ 436.0×![]()
![]() 391.55×3)kJ mol1=46.2 kJ mol1。
391.55×3)kJ mol1=46.2 kJ mol1。
(3)由已知反应①×2+②×![]() ③×
③×![]() ,得2C(s,石墨)+H2(g)
,得2C(s,石墨)+H2(g) ![]() C2H2(g)ΔH=393.5 kJ mol1×2+(571.6 kJ·mol1)×
C2H2(g)ΔH=393.5 kJ mol1×2+(571.6 kJ·mol1)×![]()
![]() (2599 kJ·mol1)×
(2599 kJ·mol1)×![]()
![]() =226.7 kJ·mol1。
=226.7 kJ·mol1。
(4)第一个热化学方程式减去第二个热化学方程式,得4Al(s)+2Fe2O3(s) ![]() 2Al2O3(s)+4Fe(s) ΔH=ΔH1ΔH2,因铝热反应是放热反应,则ΔH<0,即ΔH1ΔH2<0,ΔH1<ΔH2。
2Al2O3(s)+4Fe(s) ΔH=ΔH1ΔH2,因铝热反应是放热反应,则ΔH<0,即ΔH1ΔH2<0,ΔH1<ΔH2。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:
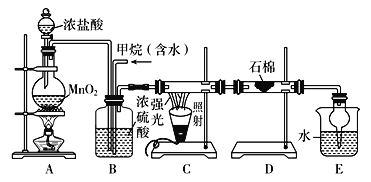
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设![]() =x,若理论上欲获得最多的氯化氢,则x取值范围________。
=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)D装置的石棉中均匀混有KI粉末,其作用是______________。
(4)E装置的作用是________(填编号)。
A 收集气体 B 吸收氯气
C 防止倒吸 D 吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(6)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a CH4 b CH3Cl c CH2Cl2 d CHCl3 e CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
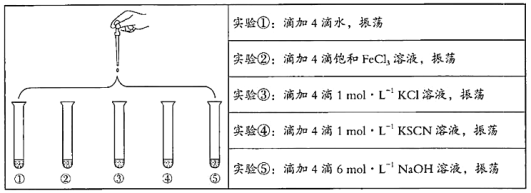
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法符合事实的是 ( )
A.CO2通入水玻璃中得到白色沉淀
B.SiO2溶于水成为硅酸
C.CO2通入饱和CaCl2溶液能生成白色沉淀
D.硅酸酸性比碳酸弱,所以SiO2不能跟Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法(在工业上都有应用):
①焦炭法 ②水煤气(或氢气,或一氧化碳)法 ③活泼金属置换法 ④电解法。
古代方法有:(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;
现代方法有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁。
对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用①
B.(Ⅱ)用②
C.(Ⅲ)用③
D.(Ⅳ)用④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰锂电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
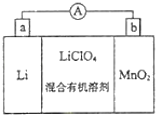
(1)外电路的电流方向是______(填“a→b”或“b→a”)。
(2)电池正极反应式_______。
(3)不能用水代替电池中的混合有机溶剂,原因是________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_____,K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g)![]() C4H8(g)+H2(g)
C4H8(g)+H2(g) ![]() H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[
H=+123kJ·mol-1。该工艺过程中生成的副产物有炭(C)、C2H6、C2H4、C4H6等。进料比[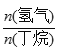 ]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用是活化固体催化剂。
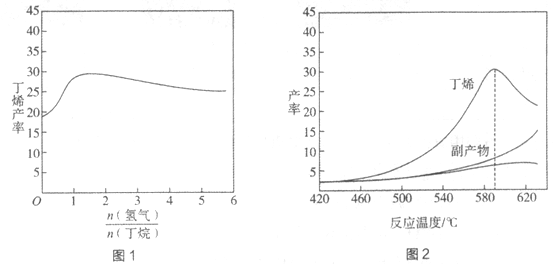
下列分析正确的是
A. 氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率
B. 丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大
C. 随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率
D. 一定温度下,控制进料比[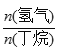 ]越小,越有利于提高丁烯的产率
]越小,越有利于提高丁烯的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和黏合剂等高聚物。为研究X的组成与结构,进行了如下实验:
(1)有机物X的质谱图为: | |
| 有机物X的相对分子质量是________。 |
(2)将10.0 g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2 g,KOH浓溶液增重22.0 g。 | 有机物X的分子式是______。 |
(3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3∶1。 | 有机物X的结构简式是__________。 |
II.写出与![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式和名称:________________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度为2 mol·L-1的盐酸V L,欲使其浓度变为4 mol·L-1,以下列出的方法中可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 蒸发掉0.5V L水
D. 加入10 mol·L-1盐酸0.6V L,再将溶液稀释至2V L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com