
【题目】在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示)。向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应。在此实验过程中:
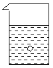
(1)烧杯里观察到的实验现象有:① ____,② ______。
(2)写出实验过程中反应的离子方程式____。
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。ΔH
CH3OH(g)。ΔH
(1)平衡常数表达式为K=_______。
(2)下图是该反应在不同温度下CO的转化率随时间变化的曲线。
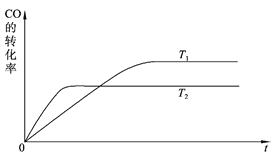
① 该反应的焓变ΔH________0(填“>”、“<”或“=”)。
② T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
③ 若容器容积不变,下列措施可增加甲醇产率的是_______。
a. 升高温度 b. 将CH3OH(g)从体系中分离
c. 使用合适的催化剂 d. 充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 二氯甲烷只有一种结构,可以证明甲烷是正四面体结构
B. 乙烯和甲苯分子中所有原子都在同一个平面上
C. 一定条件下,Cl2在甲苯的苯环或侧链上均能发生取代反应
D. ![]() 和CH3—CH==CH2互为同分异构体
和CH3—CH==CH2互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:E是石油裂解气的主要成份,其产量可以用来衡量一个国家的石油化工发展水平,E在标准状况下的密度为1.25 g·L-1,D是一种具有香味的物质,各物质间的转化如下图所示(有的反应条件和产物已略去)。
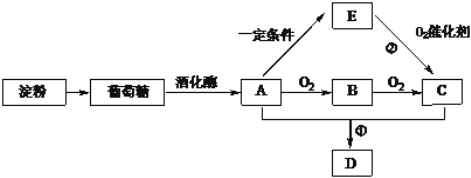
请回答下列问题:
(1)化合物B的结构简式为 __________,E中官能团的名称为__________。
(2)写出反应①的化学方程式__________________,反应类型___________。
(3)列说法正确的是__________。
A.用新制氢氧化铜悬浊液可以区分有机物B、C和D
B.乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素
C.乙酸乙酯在氢氧化钠溶液中水解的反应,可称为皂化反应
D.通过分液乙酸乙酯和有机物A的混合物,可分离得到纯的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
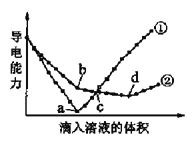
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. 曲线①的c点和曲线②的c点所代表的溶液酸碱性相同
D. a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKC1溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(C1-)、pAg=-1gc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是
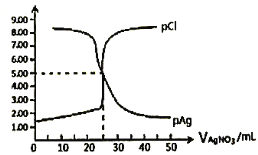
A. Ag2CrO4沉淀一定不是白色
B. AgC1的溶度积常数Ksp数量级为10-10
C. Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L
D. 加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是
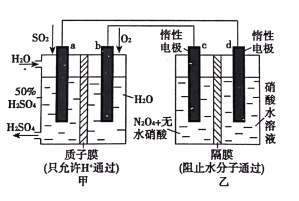
A. 电极b反应式是O2+4e-+2H2O=4OH-
B. 乙装置d电极附近溶液的pH增大
C. c电极上的电极反应式为N2O4-2e-+H2O=N2O5+2H+
D. 每转移2mole-生成2molN2O5和1molH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM="-lg" c(M),pc(CO32-)=" -lg" cc(CO32-)。下列说法正确的是 ( )

A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a 点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-)
C. b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D. c 点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)甲装置中仪器A的名称为___________。
(2)用甲装置制氯气,MnO4- 被还原为Mn2+,该反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到__________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②_______________________________。
(4)如果缺少乙装置,可能发生的副反应的化学方程式为___________________;己装置的作用是_________________:
A.除去未反应的氯气,防止污染空气
B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解
D.防止空气中O2进入戊装置的试管中使产物氧化
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
A. H2O2溶液 B. FeCl3溶液(滴有KSCN) C. AgNO3溶液 D. 溴水
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38gSnCl4,则SnCl4的产率为________。(保留3位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com