
【题目】在 2 L 容积不变的密闭容器内,800 ℃时反应 2NO(g)+O2 (g)![]() 2NO2 (g)体系中,n(NO)随时间的变化如下表:
2NO2 (g)体系中,n(NO)随时间的变化如下表:

(1)用O2的反应速率表示 0~2s 内该反应的平均反应速率 v=________________。若上述反应在850 ℃下进行,反应2s时 n(NO)=0.009 mol,并且不再随时间而改变,则该反应是__________热反应。

(2)图中表示NO2浓度变化的曲线是__________(填字母)。
(3)能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2)
B.容器内的压强保持不变
C.v逆(NO)=2v正(O2)
D.容器内气体密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________(填序号)。
A.及时分离出NO2
B.适当升高温度
C.增大O2的浓度
D.选择高效催化剂
【答案】(1)0.0015 mol·L-1·s-1(2 分) 放(1 分)
(2)b (1 分) (3)BC(2 分) (4)C(2分)
【解析】
试题分析:(1)0~2s 时NO变化的物质的量为0.02mol-0.008mol=0.012mol,则O2的变化物质的量为0.006mol,用O2表示的反应速率为v=0.006mol÷2L÷2S=0.0015 mol·L-1·s-1;升高温度,NO的物质的量增加,说明平衡逆向移动,可知此反应为放热反应;
(2)NO2是产物,随反应进行浓度增大,平衡时浓度为NO浓度的变化量△c(NO)=![]()
=0.0065mol/L,所以图中表示NO2变化的曲线是b;
(3)A.v(SO3)=2v(O2),只是表示了正反应速率之比,无法判断正逆反应速率是否相等,故A错误;B.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故B正确;C.v逆(NO)=2v正(O2)时,说明一氧化氮正逆反应速率相等,反应达到平衡状态,故C正确;D.恒容容器,反应物生成物都是气体质量不变,所以密度不变不一定平衡,故D错误;故选BC;
(4)2NO(g)+O2(g)═2NO2(g)△H<0,反应是气体体积减小的放热反应,采取下列措施,其中能使该反应的反应速率增大,且平衡向正反应方向移动;A.及时分离除NO2气体,减少生成物浓度,平衡正向进行,但反应速率减小,故A错误;B.升高温度,平衡逆向移动,故B错误;C.增大O2的浓度,化学反应速率加快,平衡正向移动,故C正确;D.选择高效催化剂,化学反应速率加快,平衡不移动,故D错误,故答案为C.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】(化学与技术)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式 ;
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH | B.Al | C.氨水 | D.Al2O3E.NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,在等体积的 ① pH=0的H2SO4溶液、② 0.05 mol/L的Ba (OH)2溶液、③ pH=10的Na2S溶液、④ pH=5的NH4NO3溶液中,发生电离的水的物质的量之比 。
(2)常温下,0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合后:
c(CH3COO) + c(CH3COOH)= mol/L
c(H+) c(CH3COO) - c(CH3COOH) +2c(OH) (填“>”、“<”或“=”)
(3)常温下,把pH=11的氢氧化钠溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系是 。
(4)常温下,把pH=2的H2SO4和pH=11的NaOH溶液混和,混和液pH=7。则两溶液的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
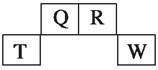
(1)T元素的离子结构示意图为__________。
(2)元素的非金属性(原子得电子的能力):Q ________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,该反应的化学方程式为_________________________________________
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是_________________________________________________________其反应物的电子式为 。离子半径T3+__________R3-(填“>”、“<”、“=”)
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:
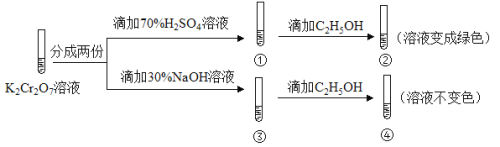
结合实验,下列说法不正确的是
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①~⑩十种元素,在元素周期表中的位置如图所示。回答下列问题:
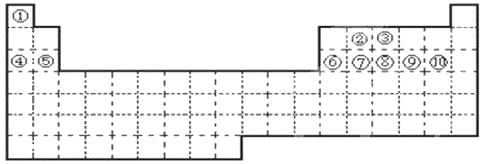
(1)在上述十种元素中,置换酸中氢的能力最强的元素为 (填化学符号,下同);最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ;原子半径最大的元素是 ,半径最小的离子是 。
(2)上述十种元素中,金属性最强的元素在周期表中的位置是第 周期 族,该元素的单质在空气中燃烧的化学方程式为 。
(3)试用电子式表示元素①和③形成分子的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g) ![]() 3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
3C(g)+nD(g),开始时A为4 mol,B为6 mol,5 min末时测得C的物质的量为3 mol,用D表示的化学反应速率v(D)为0.2 mol/(L·min)。计算:
(1)5 min末A的物质的量浓度为 。
(2)前5 min内用B表示的化学反应速率v(B)为 。
(3)化学方程式中n值为 。
(4) 5min后A的转化率为 。
(5)此反应在四种不同情况下的反应速率分别为:
①v(A)=5 mol/(L·min) ②v(B)= 6 mol/(L·min)
③v(C)=4.5 mol/(L·min) ④v(D)=8 mol/(L·min)
其中反应速率最快的是 (填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修2:化学与技术】硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等。工业制取硝酸铵的工艺流程如下:
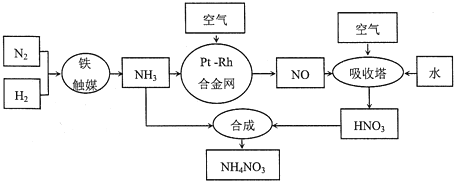
(1)合成氨气的工业设备名称_______________,设备中设置热交换器的目的是____________,合成氨的原料气必须先脱硫,目的是_______________;
(2)吸收塔中反应的化学方程式为_________________________,从生产流程看,吸收塔中需要补充空气,其原因是_______________;
(3)生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理:
方法一:碱性溶液吸收法
NO+NO2+2NaOH═2NaNO2+H2O;2NO2+Na2CO3═NaNO2+NaNO3+CO2
方法二:NH3还原法
8NH3(g)+6NO2(g)═7N2(g)+12H2O(g)△H=-2635kJ/mol(NO也有类似的反应)
方法三:甲烷吸收法
CH4(g)+2NO2═CO2(g)+N2+2H2O(g)△H=+867kJ/mol(NO也有类似的反应)
上述三种方法中,方法一的主要缺点是_______________;
方法三和方法二相比,方法三的缺点是_______________;
(4)工业上也可以通过电解NO制备NH4NO3,其工作原理如图所示.
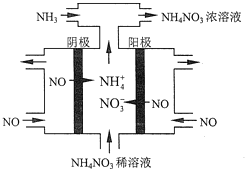
①图中通入NH3的目的是_______________;
②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_____g;(已知F=96500Cmol-l)(保留2位有效数字).
(5)某化肥厂用NH3制备NH4NO3.己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
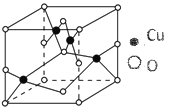
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com