
| A. | 把浑浊的液体倒入蒸发皿内加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 加入试剂的顺序为Na2CO3、BaCl2、NaOH、HCl | |
| D. | 用过滤法除去粗盐中的泥沙 |
分析 粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先除去镁离子或硫酸根离子,再除去钙离子,过滤后,最后加盐酸,在蒸发皿中蒸发,并用玻璃棒不断搅拌,以此解答该题.
解答 解:A.浑浊的液体应过滤后再蒸发,故A错误;
B.蒸发时应不断用玻璃棒搅拌,防止液体受热不均匀而飞溅,故B错误;
C.粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先除去镁离子或硫酸根离子,再除去钙离子,应先加入氯化钡或氢氧化钠,再加入碳酸钠,最后加入盐酸,故C错误;
D.泥沙不溶于水,可用过滤的方法除杂,故D正确.
故选D.
点评 本题粗盐的提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验操作的原理、方法以及相关注意事项,难度不大,注意相关知识的积累.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
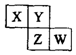 短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )
短周期元素X、Y、Z、W在元素周期表中的位置关系如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高正化合价:Z>W>X | |
| C. | 氢化物溶液的pH:W>X | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17gOH-中含有的电子数为10NA | |
| B. | 标准状况下,lmol CCl4的体积约为22.4L | |
| C. | 1mol/LNa2CO3溶液中含有的Na+离子数为2NA | |
| D. | 常温常压下,1NA个CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2△H和2K | B. | -2△H和K2 | C. | 2△H和-2K | D. | -2△H和K-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
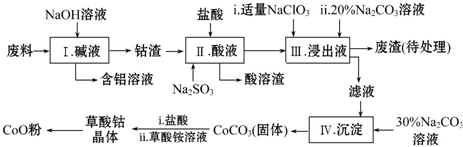
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 5.2 |
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘的CCl4溶液呈紫红色 | |
| B. | 碘在CCl4中的溶解度比在水中的溶解度大 | |
| C. | 萃取时,要充分振荡混合液体并适当旋转活塞排气减压 | |
| D. | 分液时,水从分液漏斗下口流出,碘的CCl4溶液从漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
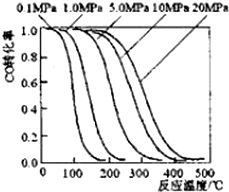 甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )
甲醇是重要的基础化工原料又是一种新型的燃料,制取甲醇传统法是采用CuO~ZnO/γ-Al2O3催化剂,合成反应为:CO+2H2 $?_{高温高压}^{催化剂}$ CH3OH,工艺中一些参数如图;目前正在开发的新法2CH4+O2$?_{高温高压}^{催化剂}$2CH3OH,下列有关新法和旧法的说法正确的是( )| A. | 旧法生产中,由图知CO与H2合成甲醇的反应属于放热反应 | |
| B. | 旧法生产中,选择合适的催化剂时,可推测高压法合成比低压法合成更有发展优势 | |
| C. | 新法与旧法相比,反应更困难 | |
| D. | 新法生产中,需控制V(CH4)/V(O2)=9:1,目的是提高空气中氧气的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com