
【题目】相对分子质量为112的有机物X完全燃烧只生成CO2和H2O,若X含一个六元碳环且可以发生银镜反应,则环上一溴代物的种类为( )
A.2
B.3
C.4
D.5
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
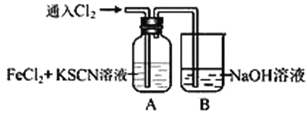
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为 ![]() 。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgCl(s)与AgI(s)分别在溶液中达到沉淀溶解平衡,相关离子浓度的关系如下图所示。下列说法正确的是

A. 曲线Y表示![]() 与
与![]() 的变化关系
的变化关系
B. t℃时,向Z点对应的溶液中加入蒸馏水,可使溶液变为曲线X对应的饱和溶液
C. t℃时,AgCl(s)+I-(aq)![]() AgI(s)+Cl-(aq)的平衡常数K=1×103
AgI(s)+Cl-(aq)的平衡常数K=1×103
D. t℃时,向浓度均为0.1mol/ L的KI与KCl混合溶液中加入AgNO3溶液,当Cl-刚好完全沉淀时,此时c(I-) = 1×10-11 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g) ![]() 2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
2CO2(g)+S(l)△H<0若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能大量共存的是
A.Cu2+、 H+、SO42— B.Ba2+、NO3—、CO32—
C.Al3+、H+、CO32— D.OH—、Fe2+、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化关系如图所示。已知X的原子半径在所有原子中最小;Y的一种核素的质量数为15,中子数为8;W的最高价氧化物的水化物在含氧酸中酸性最强。下列说法不正确的是( )
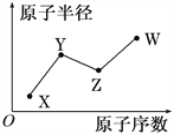
A. X元素有多种核素
B. X与Y可形成YX3型共价化合物
C. Y元素的电负性一定小于Z元素
D. W元素的单质有强氧化性,它不可能与水发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢,设计方案中一组数据如表:
编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
浓度/(molL﹣1) | 体积/mL | 浓度/(molL﹣1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4 , 标况下,每生成89.6LCO2气体,转移mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式 .
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=molL﹣1min﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com