
 用NA表示阿伏加德罗常数的值。下列叙述正确的是
用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A. 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA
A. 一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8NA
 B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
 C. 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA
C. 室温下,23gNO2和N2O4的混合气体中含有的N原子数目为0.75NA
 D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA
科目:高中化学 来源: 题型:
已知有热化学方程式:SO2(g)+ 1/2O2(g)==SO3(g) △H =-98.32kJ/mol现有5molSO2参加反应,当放出393.28kJ热量时,SO2的转化率最接近于
A.40% B.50% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的分离方法不正确的是
A. 用过滤的方法除去食盐中泥沙 B.用蒸馏的方法将自来水制成蒸馏水
C. 用酒精萃取碘水中的碘 D. 用水冲洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)多少克锌与500ml 0.1mol/L硫酸恰好反应,在标准状况下能生成多少升氢气?
(2)计算溶质的质量分数为36.5%的浓盐酸(密度为1.19g/cm3)的物质的量浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,二氧化氮和四氧化二氮之间存在平衡:2NO2(g) 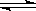 N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果最接近46的是
N2O4(g) △H<0 在测定NO2的相对分子质量时,下列条件中测定结果最接近46的是
A.130℃ 3.03×105 Pa B.25℃ 1.01×105 Pa
C.130℃ 5.05×104 Pa D.0℃ 5.05×104 Pa
查看答案和解析>>
科目:高中化学 来源: 题型:
已知450 ℃时,反应H2(g)+I2(g) 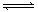 2HI(g)的K = 50,由此推测在450 ℃时,反应2HI(g)
2HI(g)的K = 50,由此推测在450 ℃时,反应2HI(g) 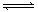 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C、100 D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
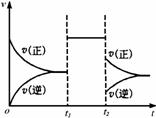
可逆反应aX+2Y(g) 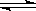 2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是
2Z(g)在一定条件下的达到平衡后,t1和t2时各改变某一种外界条件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是
A.若X是固体,则t1时一定是增大了容 器的压强
B.若X是气体,则t2时可能是增大了容器的压强
C.若X是固体,则t1时可能是增大了X的质量
D.t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
容积固定的密闭容器中存在如下反应:A(g)+3B(g)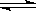 2C(g) △H<0
2C(g) △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
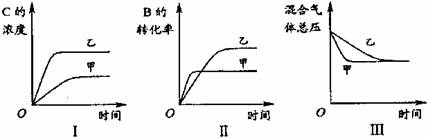
下列判断一定错误的是
①图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
②图Ⅱ研究的是压强对反应的影响,且甲的压强较高
③图Ⅱ研究的是温度对反应的影响,且甲的温度较高
④图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | a kJ |
下列叙述不正确的是
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量为23.15 kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com