
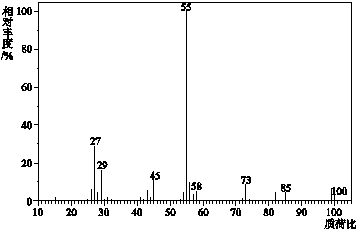
 (1)有机物X 的质谱图为: (1)有机物X 的质谱图为: | (1)有机物X的相对分子质量是 |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是 |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3:1. | (3)有机物X的结构简式是 |
| a.金属钠 | b.10%氢氧化钠溶液 | c.2%硫酸铜溶液 |
| d.2%硝酸银溶液 | e.饱和碳酸钠溶液 |
| 7.2g |
| 18g/mol |
| 22.0g |
| 44g/mol |
| 7.2g |
| 18g/mol |
| 22.0g |
| 44g/mol |
| 3.2g |
| 16g/mol |
| 一定条件 |
| 一定条件 |
| △ |
| △ |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用焰色反应可鉴别KC1溶液和NaCl溶液 |
| B、利用丁达尔效应可鉴别溶液和胶体 |
| C、运用过滤的方法,可以分离泥沙和氯化钠溶液混合物 |
| D、用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④⑥ |
| C、①③⑥ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、提纯含杂质的工业酒精选择装置③ |
| B、提纯含杂质的粗苯甲酸选择装置①② |
| C、从溴水中提纯溴选择装置④ |
| D、苯中混有少量苯酚选择装置④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的颜色逐渐变浅 |
| B、平衡向正反应方向移动 |
| C、溶液由浅绿色变成黄色 |
| D、平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com