
| A. | 300 mL 1 mol•L-1NaCl溶液 | B. | 75 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1KCl溶液 | D. | 75 mL 1 mol•L-1AlCl3溶液 |
分析 根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关.
解答 解:150mL 1mol•L-1MgCl2溶液中的Cl-的物质的量浓度为:c(Cl-)=2c(MgCl2)=2mol•L-1,
A.300 mL 1 mol•L-1NaCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(NaCl)=1mol•L-1,故A错误;
B.75 mL 2 mol•L-1CaCl2溶液中Cl-的物质的量浓度为:c(Cl-)=2c(CaCl2)=4mol•L-1,故B错误;
C.150 mL 2 mol•L-1KCl溶液中Cl-的物质的量浓度为:c(Cl-)=c(KCl)=2mol•L-1,故C正确;
D.75 mL 1 mol•L-1AlCl3溶液中Cl-的物质的量浓度为:c(Cl-)=3c(AlCl3)=3mol•L-1,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确物质的量浓度与溶液体积大小无关.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
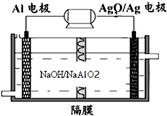 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
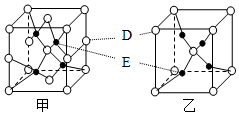 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制金属钠 | B. | 电解熔融氯化镁制金属镁 | ||
| C. | 氧化铁与一氧化碳高温反应炼铁 | D. | 焦炭高温还原二氧化硅制粗硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com