
| A. | 3.01×1023个双氢青蒿素的质量为142 g•mol-1 | |
| B. | 双氢青蒿素中的C、H、O三种元素的质量比45:6:20 | |
| C. | 7.1 g双氢青蒿素中含有的氢原子总数为1.2NA | |
| D. | 含有NA个碳原子的双氢青蒿素的物质的量为1 mol |
分析 A.质量的单位是g,摩尔质量单位是g/mol;
B.双氢青蒿素中的每一种元素的质量=元素的相对原子质量×原子个数;
C.7.1g双氢青蒿素的物质的量=$\frac{7.1g}{284g/mol}$=0.05mol,每个分子中含有44个原子,根据N=nNA及分子构成计算原子总数;
D.每个分子中含有15个C原子,含有6.02×1023个碳原子的双氢青蒿素的物质的量=$\frac{\frac{N}{{N}_{A}}}{15}$mol.
解答 解:A.质量的单位是g,摩尔质量单位是g/mol,1mol双氢青蒿素的质量是284g,故A错误;
B.双氢青蒿素中的C、H、O三种元素的质量比=(12×15):1×24:(16×5)=45:6:20,故B正确;
C.7.1g双氢青蒿素的物质的量=$\frac{7.1g}{284g/mol}$=0.025mol,每个分子中含有44个原子,根据N=nNA及分子构成计算原子总数=0.025mol×NA/mol×44=1.1NA,故C错误;
D.每个分子中含有15个C原子,含有6.02×1023个碳原子的双氢青蒿素的物质的量=$\frac{\frac{N}{{N}_{A}}}{15}$mol=$\frac{1}{15}$mol,故D错误;
故选B.
点评 本题以双氢青蒿素为载体考查物质的量有关计算,为高频考点,明确各个物理量的关系是解本题关键,注意分子数与原子个数之间的计算.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 35.5 | B. | 71g | C. | 35.5g/mol | D. | 71g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.24 g | B. | 22.8 g | C. | 17.02 g | D. | 24.84 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8mL | B. | 2.4mL | C. | 3mL | D. | 4mL或1.2mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 2.0mol•L-1 | C. | 4.0mol•L-1 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
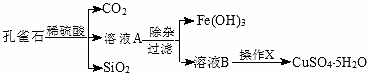
| 物质 | pH (开始沉淀) | pH④ (完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com