
| A. | n1=n2 | B. | n1>n2 | C. | n1<n2 | D. | c(A-)<c(B-) |
分析 HA的酸性比HB的酸性强,HA的电离程度大于HB,则其酸根离子水解程度A-<B-,相同温度下,物质的量浓度和体积均相同的NaA和NaB两种溶液中两种盐的物质的量相等,溶液中存在电荷守恒和物料守恒,根据电荷守恒判断.
解答 解:HA的酸性比HB的酸性强,HA的电离程度大于HB,则其酸根离子水解程度A-<B-,相同温度下,物质的量浓度和体积均相同的NaA和NaB两种溶液中两种盐的物质的量相等,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(A-)、c(Na+)+c(H+)=c(OH-)+c(B-),两种溶液中离子浓度分别是其溶液中所有阳离子浓度的2倍,
因为酸根离子水解程度A-<B-,所以NaA溶液中氢离子浓度大于NaB,两种溶液中钠离子浓度相等,所以NaA溶液中离子个数大于NaB离子个数,即n1>n2,
故选B.
点评 本题以离子个数比较为载体考查了盐类水解,明确电离平衡常数与酸根离子水解程度的关系是解本题关键,然后再采用电荷守恒、离子代换等方法来分析解答,难度中等.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
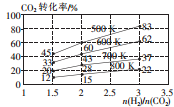 二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收再利用是减缓温室效应的有效途径之一.| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 沉淀a的主要成分是BaS04和BaC03 | |
| B. | 滤液b中Na+的物质的量为0.08 mol | |
| C. | 气体d在标准状况下的体积为224 mL | |
| D. | 原混合物中Na2S04与Na2C03的物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
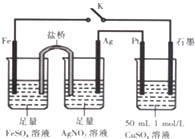
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com