
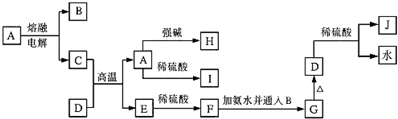
分析 C是一种日常生活中常见的单质,D是一种棕红色固体,由转化关系可知,D为Fe2O3,J为Fe2(SO4)3,G为Fe(OH)3,A为Al2O3,C为Al,B为O2,E为Fe,F为FeSO4,据此解答.
解答 解:C是一种日常生活中常见的单质,D是一种棕红色固体,由转化关系可知,D为Fe2O3,J为Fe2(SO4)3,G为Fe(OH)3,A为Al2O3,C为Al,B为O2,E为Fe,F为FeSO4.
(1)C的名称为铝,J的化学式为Fe2(SO4)3,故答案为:铝;Fe2(SO4)3;
(2)由A生成H的离子反应方程式:Al2O3+2OH-+3H2O=2[Al(OH)4]-,故答案为:Al2O3+2OH-+3H2O=2[Al(OH)4]-;
(3)某气体能使品红溶液褪色,但加热后又恢复,该气体为二氧化硫,二氧化硫通入Fe2(SO4)3溶液中发生反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查无机物推断,涉及Fe、Al元素化合物性质,D的颜色是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
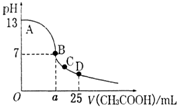 室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )
室温下,在25mL 0.1mol.L-1NaOH溶液中逐滴加入0.2mol•L-1 CH3COOH 溶液,pH 与滴加 CH3COOH溶液体积的关系曲线如图所示,若忽略两溶液混合时的体积变化,下列有关粒子浓度关系的说法错误的是( )| A. | 全部正确 | B. | ①② | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1mol的-OH与1mol的OH-所含电子数均为10NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | Na2O2的反应中,每生成0.1molO2,转移电子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com