
【题目】已知1-丁醇的沸点为117.7℃,乙酸的沸点为118℃。甲同学拟在浓硫酸作用下,使1-丁醇和乙酸进行酯化反应制乙酸丁酯(反应温度115~125℃)。

(1)反应装置不使用水浴加热或直接加热,而采取如图加热操作方式,其原因是____________________________。
(2)操作中使用相对较多乙酸的理由是______________________________。
(3)洗涤粗产物:将粗产物移至分液漏斗中,先用水洗涤,然后用10%Na2CO3溶液洗涤至中性,再用水洗涤,分液得有机层。如果不能判断哪层是有机层,可以用__________方法来判断。对有机层,进行洗涤除杂、除水后可得到粗产品。
(4)收集产物:将干燥好的产物移至蒸馏烧瓶中,加热蒸馏,收集125~127℃的馏分。要证明最终产物是纯净的乙酸丁酯,其方法是__________________________________。乙同学拟通过蒸馏的方法将1-丁醇和乙酸的无水混合物分离开。
实验步骤:①连接好装置,检查装置的气密性。②将混合物加入到蒸馏烧瓶中,并加入适量的试剂a。③加热到118℃,并收集馏分。④冷却后,再向烧瓶中加入试剂b。⑤加热到118℃,并收集馏分。
(5)试剂a 是___________,其作用是_________________________________。
(6)下列实验也需要用到温度计的是 ____________。
a.实验室制备硝基苯 b.实验室制备溴苯 c.实验室制备乙烯 d.银镜反应
【答案】反应温度为115~125℃不能水浴,直接加热容易炭化 乙酸相对廉价,提高1-丁醇的转化率 从任意一层取少量液体加水,如混溶则该层为水层;不混溶则为有机层 测定产品的沸点 生石灰 让乙酸反应后生成高沸点的离子化合物,以提高1-丁醇的纯度 a、c
【解析】
(1)1-丁醇的沸点为117.7℃,乙酸的沸点为118℃,都比水的沸点高,则不能用水浴的方法加热,否则达不到反应温度,火焰不与试管接触,可防止直接加热到导致碳化;
(2)加入乙酸平衡右移,可提高1-丁醇的转化率,且乙酸相对价格较为便宜;
(3)乙酸丁酯与水互不相溶,可从任意一层取少量液体加水,如混溶则该层为水层,不混溶则为有机层;
(4)混合物没有固定的熔沸点,可通过测定产品的沸点判断,如有固定的沸点,则为纯净物,否则不是;
(5)乙酸具有酸性,可与CaO等碱性物质反应,让乙酸反应后生成高沸点的离子化合物,利于分馏分离;
(6)实验室制备硝基苯需要加热到50~60℃;制备乙烯需要加热到170℃,而制备溴苯无需加热,而银镜反应可用沸水浴,无需加热,所以选a、c。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】共价化合物分子中各原子有一定的连接方式,某分子可用球棍模型表示如图,A的原子半径最小,C、D位于同周期,D的常见单质常温下为气态,下列说法正确的是( )
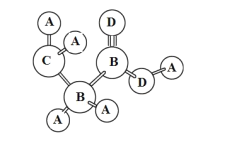
A.B的同素异形体数目最多2种
B.A与C不可以形成离子化合物
C.通过含氧酸酸性可以比较元素B和C的非金属性
D.C与D形成的阴离子CD2-既有氧化性,又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物在自然界中数目非常庞大,对此你认为下列解释不合理的是( )
A.碳原子能与其他原子形成四个共价键
B.有机化合物存在同分异构现象
C.碳是非金属元素
D.碳原子能与![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等多种非金属原子形成共价化合物,且原子连接方式多样
等多种非金属原子形成共价化合物,且原子连接方式多样
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A. 、
、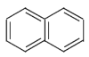 、
、 互为同系物
互为同系物
B.有机化合物 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.有机化合物![]() 的分子式为
的分子式为![]() ,且能与
,且能与![]() 溶液反应产生
溶液反应产生![]() ,其同分异构体有8种
,其同分异构体有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”,现代工业开发了用NH3—NH4Cl水溶液浸出氧化锌烟灰(主要成分为ZnO 、少量Pb、CuO和As2O3)制取高纯锌的工艺流程如图所示。
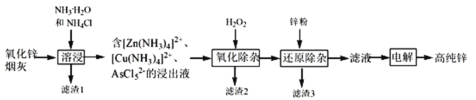
请回答下列问题:
(1)《天工开物》中炼锌的方法中“泥封”的目的是____________。
(2)滤渣1的主要成份分别是_______(填化学式),“过滤”用到的玻璃仪器是__________。
(3) “溶浸”时,氧化铜参与反应的相关离子方程式是________;“溶浸”时可以适当升高温度,但不宜过高,其原因是________________。
(4) “氧化除杂”的目的是将AsCl52-转化为As2O5胶体,再经吸附聚沉除去,溶液始终接近中性,该反应的离子方程式是_____________________。
(5) “电解”含 [Zn(NH3)4]2+的溶液,阴极放电的电极反应式是_________。阳极区产生一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的使用正确的是( )
A.在基态多电子原子中,p轨道电子的能量一定高于s轨道电子的能量
B.Fe原子的外围电子排布图为![]()
C.氧的电负性比氮大,故氧元素的第一电离能比氮元素的第一电离能大
D.铜原子的外围电子排布式为3d94s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核外电子排布式为![]() 的原子与原子核外电子排布式为
的原子与原子核外电子排布式为![]() 的原子对应元素的化学性质相似
的原子对应元素的化学性质相似
B.![]() 的最外层电子排布式为
的最外层电子排布式为![]()
C.基态铜原子外围电子排布图为![]()
D.基态碳原子最外层电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)FeCl3溶液呈________性(填“酸”、“中”或“碱”),原因是__________________(用离子方程式表示);若把FeCl3溶液蒸干,灼烧,最后得到固体产物是 ____________,原因是________________________________________________。
(2)将1L 0.2 mol·L-1HA溶液与1L 0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积变化忽略不计),测得混合溶液中c(Na+)>c(A-),则混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)浓度均为0.1 mol/L的四种溶液①氯化铵溶液、②碳酸氢铵溶液、③氨水、④硫酸氢铵中,NH4+浓度由大到小的顺序为_______________________________。
(4)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
2PbSO4+2H2O。放电时,负极的电极反应式是__________________________;充电时,当外电路通过1 mol电子时,理论上正极板的质量减少________________g。
(5)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性MgCl2溶液中含有少量的FeCl3 ,为了得到纯净的MgCl2·2H2O晶体,应加入________(填化学式),调节溶液的pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________mol·L-1。
②常温下,若将0.01 mol·L-1 MgCl2溶液与________ mol·L-1 NaOH溶液等体积混合时有沉淀生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com