
【题目】![]() 、
、![]() 、
、![]() 均为短周期主族元素,
均为短周期主族元素,![]() 、
、![]() 处于同一周期,
处于同一周期,![]() 、
、![]() 的最低价离子分别为
的最低价离子分别为![]() 和
和![]() ,
,![]() 和
和![]() 具有相同的电子层结构。下列说法正确的是( )
具有相同的电子层结构。下列说法正确的是( )
A.原子的最外层电子数:![]()
B.阴离子还原性:![]()
C.离子半径:![]()
D.原子序数:![]()
【答案】D
【解析】
X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题。
A. X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;
B.单质的非金属性越强,氧化性越强,其离子的还原性越弱,氧化性:F2>S,则还原性:S2->F-,故B错误;
C.Na+、F具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为F>Na+,S2电子层最多,离子半径最大,故离子半径S2>F>Na+,故C错误;
D.X、Y、Z的原子序数分别为16、11、9,则原子序数:X>Y>Z,故D正确;
答案选D。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某校科学活动小组对教材中“测定空气里氧气含量”的实验(如图1)进行了大胆改进,设计如图2(选用容积为40mL的试管作为反应容器和润滑性很好的注射器组装)实验方案进行。请你对比分析图1、图2实验,回答下列有关问题:
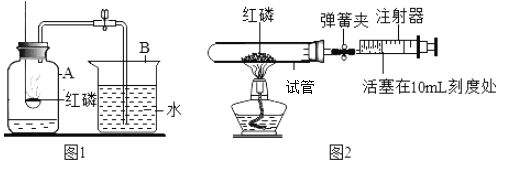
I.请结合图1回答下列问题:
(1)指出实验中A、B仪器的名称:A___;B___。
(2)写出红磷燃烧反应的表达式___。
(3)实验中点燃红磷后观察到___,待红磷熄灭并冷却至室温后,打开弹簧夹,观察到___。
(4)由此实验可推知剩余主要气体的化学性质是___(答一条即可)。
II.改用图2实验方案进行,实验的操作步骤如下:①将红磷装入试管中,将30mL的注射器活塞置于10mL刻度处,并按图2中所示的连接方式固定好,再将弹簧夹夹紧橡皮管②点燃酒精灯③撤去酒精灯,待试管冷却后松开弹簧夹④读取注射器活塞的数据。
(5)与图1比较,图2装置的优点是___(答一点即可)。
(6)若用图2装置测得的氧气体积分数小于![]() ,则可能的原因是___(写一条即可)。
,则可能的原因是___(写一条即可)。
(7)图2实验中注射器活塞将从10mL刻度处慢慢前移到约为___mL刻度处才停止(忽略导管气体体积)。
(8)若图2装置中改用容积为80mL试管且不使用夹弹簧夹,其它操作都不变,为确保实验成功,则加热前注射器活塞前沿至少应调整到___mL刻度处(填整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
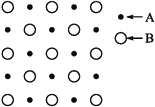
【题目】(1)某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为________
(2)Si 元素以 Si-O-Si 链构成矿物界,由许多四面体(图 l)连接成无限长的单链或双链(图 2)结构。图 2 所示的多硅酸根离子的化学式通式为________(以含正整数 n 的代数式表示)。
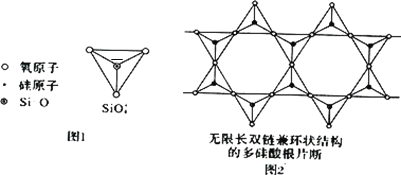
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,其原料从杨树中提取,现可用如下反应制备:
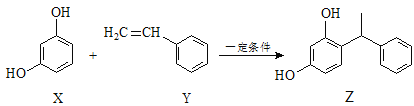
下列叙述正确的是( )
A.X、Y和Z均能使溴水褪色,且原理相同
B.X和Z均能与Na2CO3溶液反应放出CO2
C.Z中含手性碳原子
D.Y可作加聚反应的单体,X可作加聚反应的单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al及其化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____(填标号)。
A [Ne]3s1 B [Ne]3s2 C [Ne]3s23p1 D [Ne] 3s13p2
(2)熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6,二聚体Al2Cl6的结构式为_____(标出配位键);其中Al的配位数为_________。二聚体A12C16中Al原子的轨道杂化类型是________。
(3) 实际上,偏铝酸钠在水溶液中都是以Na[Al(OH)4]和形式存在,1mol Na[Al(OH)4]中含有σ键的数目为_________。
(4)Ga(镓)和铝是同一主族元素,Ga原子的电子排布式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知盐酸是强酸,在下列叙述中,能说明醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入水的量少
B.盐酸和醋酸都可用相应的钠盐与同浓度硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度下,同时发生反应A(g)![]() B(g)和A(g)
B(g)和A(g)![]() C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
C(g)。已知A(g)反应生成B(g)或C(g)的能量如图所示,下列说法正确的是
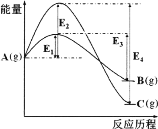
A.B(g)比C(g)稳定
B.在该温度下,反应刚开始时,产物以B为主;反应足够长时间,产物以C为主
C.反应A(g![]() )B(g)的活化能为(E3—E1)
)B(g)的活化能为(E3—E1)
D.反应A(g)![]() C(g)的ΔH<0且ΔS=0
C(g)的ΔH<0且ΔS=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:①Cl2 ②SO2 ③0.1mol·L-1Na2CO3溶液中的溶质 ④0.1mol·L-1的氨水中的NH3·H2O ⑤0.1mol·L-1CH3COOH溶液中的溶质 ⑥BaSO4。
(1)属于强电解质的是_____,属于弱电解质的是_____,属于非电解质的是_______,向⑤中加入等物质的量④,溶液导电性____(填“增强”或“减弱”)。
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。___________。
(3)在T℃时,反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K=6×102,则:
2SO3(g) △H<0的平衡常数K=6×102,则:
①温度升高,化学平衡移动后,平衡常数K值________(填“增大”、“减少”或“不变”)。
②T℃时,向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态____(填“是”或“否”),化学反应速率v(正)___v(逆)(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第三周期主族元素的某些性质随原子序数变化的柱形图,则y轴可表示( )
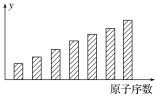
①第一电离能②电负性 ③原子半径 ④简单离子半径 ⑤最高正化合价 ⑥形成简单离子转移的电子数
A.①②③④⑤⑥B.①②③⑤
C.②④⑤D.②⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com