
| 目的 | A.实验室制取并收集O2 | B.检验装置气密性 | C.制取蒸馏水 | D.分离水和四氯化碳 |
| 装置或操作 | 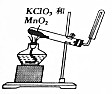 | 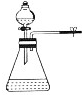 | 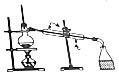 | 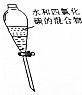 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.实验室用氯酸钾和二氧化锰混合加热制取氧气,氧气密度大于空气,要采用向上排空气法收集;
B.能形成压强差的装置可以检验装置气密性;
C.制取蒸馏水时,温度计测量馏分温度,且冷凝管中水遵循“下口进上口出”原则;
D.互不相溶的液体采用分液方法分离.
解答 解:A.实验室用氯酸钾和二氧化锰混合加热制取氧气,氧气密度大于空气,要采用向上排空气法收集,所以收集气体的试管应该口向上,故A错误;
B.能形成压强差的装置可以检验装置气密性,如果关闭止水夹,打开分液漏斗中活塞和瓶塞,如果分液漏斗中液面下降,则气密性不好,否则气密性良好,故B正确;
C.制取蒸馏水时,温度计测量馏分温度,且冷凝管中水遵循“下口进上口出”原则,符合实验操作,故C正确;
D.互不相溶的液体采用分液方法分离,水和四氯化碳不互溶,所以可以采用分液方法分离,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及气体的制取和收集、气密性检验、物质制备、物质分离提纯,明确实验原理及实验基本操作方法是解本题关键,注意从实验操作规范性及物质性质分析评价,易错选项是A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除④外都对 | B. | 除⑤外都对 | C. | ④⑤不对 | D. | 全都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ③④ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com