
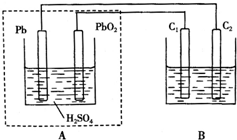
 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )| A. | 铅蓄电池工作一段时间后A溶液的pH变小 | |
| B. | 当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol | |
| C. | 当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过 | |
| D. | 铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
分析 A、根据铅蓄电池放电时,溶液中氢离子浓度的变化判断溶液PH的变化;
B、当B烧杯中I-的浓度降为0.05mol/L时消耗的物质的量=0.05×0.1=0.005mol,转移电子0.005mol;
C、当电解池中阳极上生成气体时,碘离子应该完全放电生成导致碘,然后氢氧根离子放电生成氧气;
D、铅蓄电池放电时,负极上失去电子发生氧化反应.
解答 解:A、铅蓄电池工作时反应:PbO2+2H2SO4+Pb═2PbSO4+2H2O,氢离子浓度减小,所以溶液的PH增大,故A错误;
B、当B烧杯中I-的浓度降为0.05mol/L时消耗的物质的量=0.05×0.1=0.005mol,转移电子0.005mol,2H2O+SO2-2e-=SO42-+4H+,转移电子=0.1×0.1×2=0.02mol,共转移0.025mol,据PbO2+2H2SO4+Pb═2PbSO4+2H2O得知转移2mol的电子消耗2mol的硫酸,所以消耗硫酸0.025mol,故B正确;
C、当C1、C2两极均开始产生气体时,碘离子放电完全,根据碘离子的物质的量计算通过的电子个数,碘离子的物质的量=0.1mol/L×0.1L=0.01mol,
2I--2e-=I2
2mol 2NA
0.01mol 0.01NA
所以至少已有6.02×1021个电子从电路中流过,故C错误;
D、铅蓄电池放电时,负极上铅失去电子和硫酸根离子反应生成硫酸铅,电极反应式为 Pb+SO42--2e-=PbSO4,故D错误;
故选B.
点评 本题考查了原电池原理和电解池原理,明确溶液中氢离子浓度的变化、离子的放电顺序、原电池中正负极的反应即可分析解答本题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 赤潮、白色污染、绿色食品都与相关物质的颜色有关 | |
| B. | 地震发生后,灾区急需大量消毒剂,其中SO2可用于环境消毒 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约能源,保护环境 | |
| D. | 电池一定要回收利用,主要是为了避免浪费 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 贮存液氮的钢瓶防止阳光直射:N2+O2$\frac{\underline{\;阳光\;}}{\;}$2NO | |
| B. | 硝酸铵遇热爆炸:2NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+O2↑+4H2O↑ | |
| C. | 干燥的 AlCl3遇水产生气体:AlCl3+3H2O═Al(OH)3+3HCl↑ | |
| D. | 火灾现场存有电石,禁用水灭火:CaC2→Ca(OH)2+C2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2 NA | |
| D. | 标准情况下,22.4LCl2和HCl的混合气体中含分子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
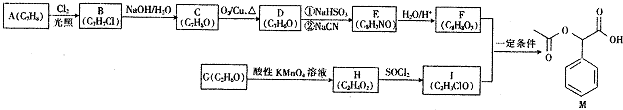
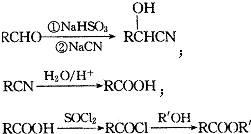 ;
;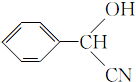 ;
; ;
;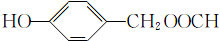 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该固体中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl-、Na+ | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素含氧酸的酸性比W的弱 | |
| B. | Z和W在自然界均能以游离态存在 | |
| C. | YZ和YZ2均可以被NaOH溶液吸收 | |
| D. | X和Y能形成既含极性键又含非极性键的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com