
| 152-96-8 |
| 16 |
| 7.6g |
| 152g/mol |
| 3.6g |
| 18g/mol |
| 0.4mol |
| 0.05mol |
| 0.4mol |
| 0.05mol |
| 152-96-8 |
| 16 |
 ,
, ;
;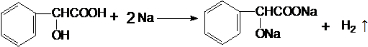 ,
, .
.


科目:高中化学 来源: 题型:
| A、Na2SO4溶液显碱性是因为SO42-+H2O?HSO4-+OH- |
| B、在NaHSO4溶液中,显酸性是因为HSO4-的电离 |
| C、NaHSO4溶液中各种离子浓度的关系是c(Na+)>c(HSO4-)>c(H+)>c(SO42-)>c(OH- ) |
| D、0.1mol?L-1 H2SO4溶液中氢离子的物质的量浓度为0.11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸和氨水恰好完全中和:CH3COOH+NH3?H2O═CH3COO-+NH4++H2O |
| B、氢溴酸溶于水中:HBr?H++Br- |
| C、Na2CO3溶液中:CO32-+2H2O?H2CO3+2OH- |
| D、在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(I):△H=-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com