
现有50g 5%的硫酸铜溶液, 要使其浓度增大一倍, 可采用的方法是
[
]A
.加入5g胆矾 B.蒸发浓缩成25g溶液C
.蒸发掉一半溶剂 D.再加入100g12.5%的硫酸铜溶液 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:阅读理解
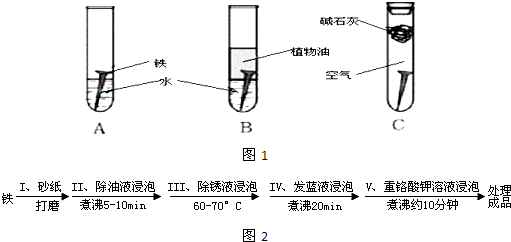
查看答案和解析>>
科目:高中化学 来源: 题型:
 铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途.
查看答案和解析>>
科目:高中化学 来源: 题型:021
现有50g5%的硫酸铜溶液. 要使其浓度增大一倍, 可采用的方法是
[ ]
A.加入5g胆矾 B.蒸发浓缩成25g溶液
C.蒸发掉一半溶剂 D.再加入100g12.5%的硫酸铜溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省汕头市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(1)在298K时,1molCH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0 kJ。写出该反应的热化学方程式 。现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18克液态水,并放出515kJ热量,则CH4和CO的物质的量分别为 、 mol.
(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入甲烷和氧气。通入甲烷气体的电极应为 极(填写“正”或“负”),该电极上发生的电极反应是 (填字母代号)。
a. CH4—e- + 2O2 == CO2 + 2H2O
b. CH4—8e- + 10OH- == CO32- + 7H2O
c. O2 + 2H2O + 4 e- == 4OH-
d. O2—4 e- + 4H+ == 2H2O
(3)在如图所示实验装置中,石墨棒上的电极反应式为 ;如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 ;若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com