
【题目】氮化钠(Na3N)晶体熔融时能导电。下列描述正确的是
A.构成晶体的两种微粒电子层结构相同
B.构成晶体的两种微粒半径相等
C.构成晶体的两种微粒的核外电子能量相同
D.构成晶体的两种微粒的电子层数不同
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】关于一些重要的化学概念,下列叙述正确的是
A.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
B.CO2、NO2、Mn2O7、P2O5 均为酸性氧化物
C.漂白粉、水玻璃、铝热剂均为混合物
D.熔融状态下,CH3COOH、NaOH、MgCl2 均能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶金厂的矿渣含有较多的Al2O3、Fe2O3、MgO、SiO2,现欲进行综合利用以提取氧化铝、氧化镁、氧化铁作为工业原料,其设计的工艺流程如下:
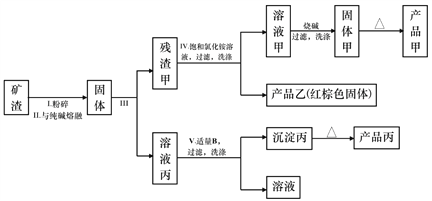
已知:
①硅酸的酸性比氢氧化铝强。
②饱和氯化铵溶液的pH约为5。
③氢氧化镁开始沉淀至沉淀完全的pH范围:9.0~12.0。
④氢氧化铁开始沉淀至沉淀完全的pH 范围:2.7~4.0。
回答下列问题:
(1)写出过程II中发生反应的化学方程式:_______________、_____________________。
(2)过程Ⅲ的名称是_______________;产品乙的俗名是_________________。
(3)过程V中所用适量的B是一种常见气体,过程V中所发生的反应的离子方程式为_______。
(4)残渣甲用饱和氯化铵溶液能部分溶解的原因是_______________(用离子方程式表示)。
(5)解释工业上不用电解产品甲制备相应金属单质的原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列有关说法不正确的是( )
A.45g水中含有的水分子数是2.5NA
B.标准状况下,33.6LCO中含有的原子数是3NA
C.0.5L,0.2mol/L的NaCl溶液中含有的Na+数是0.1NA
D.1molCH4含电子数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子晶体中一定存在分子间作用力
B.分子中含有两个氢原子的酸一定是二元酸
C.含有金属阳离子的晶体一定是离子晶体
D.元素的金属性越强,失去的电子数就越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则碳元素的质量分数为
A. 27% B. 28% C. 54% D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1moL/L醋酸用蒸馏水稀释的过程中,下列说法正确的是( )
A.电离程度增大,H+浓度增大B.电离程度减小,H+浓度减小
C.电离程度增大,H+浓度减小D.电离程度减小,H+浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com