
”¾ĢāÄæ”湤ŅµÉĻæÉÓĆĪ¢ÉśĪļ“¦Ąķŗ¬KCNµÄ·ĻĖ®”£µŚŅ»²½ŹĒĪ¢ÉśĪļŌŚŃõĘų³ä×ćµÄĢõ¼žĻĀ£¬½«KCN×Ŗ»Æ³ÉKHCO3ŗĶNH3£Ø×ī¼ŃpH : 6.7”«7.2)£»µŚ¶ž²½ŹĒ°Ń°±×Ŗ»ÆĪŖĻõĖį£ŗNH3+202![]() HNO3+H2O
HNO3+H2O
ĒėĶź³ÉĻĀĮŠĢīæÕ£ŗ
£Ø1£©Š“³öµŚŅ»²½·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½_____________£¬µŚ¶ž²½·“Ó¦µÄ»¹Ō²śĪļŹĒ_____________ £ØĢīŠ“»ÆѧŹ½£©”£
£Ø2£©ŌŚKCNÖŠ£¬ŹōÓŚ¶ĢÖÜĘŚĒŅŌ×Ó°ė¾¶×ī“óµÄŌŖĖŲŹĒ_____£¬µŖŌ×Ó×īĶā²ćµē×ÓµÄŌĖ¶ÆדĢ¬ÓŠ_______ÖÖ”£Ė®µÄµē×ÓŹ½ŹĒ________”£
£Ø3£©±Č½ĻĢ¼ŗĶµŖŌŖĖŲ·Ē½šŹōŠŌĒæČõ£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖ_____________”£
£Ø4£©ŹŅĪÕĻĀ£¬0.lmol/LK2CO3”¢KCN”¢KHCO3ČÜŅŗ¾ł³Ź¼īŠŌĒŅpHŅĄ“Ī¼õŠ”£¬ŌŚŗ¬µČĪļÖŹµÄĮæµÄKCN”¢KHCO3»ģŗĻČÜŅŗÖŠ£¬ŅõĄė×ӣسżOH-£©ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ_____________”£
£Ø5£©¹¤ŅµÉĻ»¹³£ÓĆĀČŃõ»Æ·Ø“¦·²ŗ¬KCNµÄ·ĻĖ®£ŗKCN+2KOH+Cl2=KOCN+2KCl+H2O£¬2KOCN+4KOH+3Cl2”śN2+6KCl+2CO2+2H2O”£Į½°ēĻą±Č£¬Ī¢ÉśĪļ“¦Ąķ·ØµÄÓŵćÓėȱµćŹĒ£Øø÷Š“Ņ»Ģõ£©”£
Óŵć£ŗ________£»Č±µć£ŗ__________________”£
”¾“š°ø”æ 2KCN+O2+4H2O![]() 2KHCO3+2NH3 (2·Ö£©HNO3 H2O Ģ¼(C) 5
2KHCO3+2NH3 (2·Ö£©HNO3 H2O Ģ¼(C) 5 ![]() NaHCO3+HNO3=NaNO3+CO2”ü+H2O c(HCO3-)>c(CN-)>c(CO32-) ²»“ęŌŚŅŗĀČŠ¹Ā©µČ Ī¢ÉśĪļŹŹÓ¦ŠŌ²īµČ”£
NaHCO3+HNO3=NaNO3+CO2”ü+H2O c(HCO3-)>c(CN-)>c(CO32-) ²»“ęŌŚŅŗĀČŠ¹Ā©µČ Ī¢ÉśĪļŹŹÓ¦ŠŌ²īµČ”£
”¾½āĪö”æ£Ø1£©øł¾Żµē×ӵƏ§ŹŲŗćŗĶŌ×ÓŹŲŗćæÉÖŖ·“Ó¦Īļ»¹ÓŠĖ®£¬ŅĄ“ĪµŚŅ»²½·“Ó¦µÄ»Æѧ·“Ó¦·½³ĢŹ½ĪŖ2KCN+O2+4H2O![]() 2KHCO3+2NH3£»µŚ¶ž²½·“Ó¦ÖŠŃõĘųŹĒŃõ»Æ¼Į£¬»¹Ō²śĪļŹĒHNO3ŗĶH2O”££Ø2£©ŌŚKCNÖŠ£¬ŹōÓŚ¶ĢÖÜĘŚµÄŹĒC”¢N£¬Ķ¬ÖÜĘŚ×Ō×óĻņÓŅŌ×Ó°ė¾¶Öš½„¼õŠ”£¬ŌņŌ×Ó°ė¾¶×ī“óµÄŌŖĖŲŹĒC£¬µŖŌ×Ó×īĶā²ćÓŠ5øöµē×Ó£¬ŅĄ“Īµē×ÓµÄŌĖ¶ÆדĢ¬ÓŠ5ÖÖ”£Ė®ŹĒ¹²¼Ū»ÆŗĻĪļ£¬µē×ÓŹ½ŹĒ
2KHCO3+2NH3£»µŚ¶ž²½·“Ó¦ÖŠŃõĘųŹĒŃõ»Æ¼Į£¬»¹Ō²śĪļŹĒHNO3ŗĶH2O”££Ø2£©ŌŚKCNÖŠ£¬ŹōÓŚ¶ĢÖÜĘŚµÄŹĒC”¢N£¬Ķ¬ÖÜĘŚ×Ō×óĻņÓŅŌ×Ó°ė¾¶Öš½„¼õŠ”£¬ŌņŌ×Ó°ė¾¶×ī“óµÄŌŖĖŲŹĒC£¬µŖŌ×Ó×īĶā²ćÓŠ5øöµē×Ó£¬ŅĄ“Īµē×ÓµÄŌĖ¶ÆדĢ¬ÓŠ5ÖÖ”£Ė®ŹĒ¹²¼Ū»ÆŗĻĪļ£¬µē×ÓŹ½ŹĒ![]() ”££Ø3£©ĻõĖįÄÜÓėĢ¼ĖįĒāÄĘ·“Ӧɜ³ÉĢ¼Ėį£¬ĖµĆ÷µŖŌŖĖŲµÄ·Ē½šŹōŠŌĒæÓŚĢ¼ŌŖĖŲ£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖNaHCO3+HNO3=NaNO3+CO2”ü+H2O”££Ø4£©ŹŅĪĀĻĀ0.lmol/LK2CO3”¢KCN”¢KHCO3ČÜŅŗ¾ł³Ź¼īŠŌĒŅpHŅĄ“Ī¼õŠ”£¬ĖµĆ÷ĖįøłĄė×ÓµÄĖ®½ā³Ģ¶ČŅĄ“Ī¼õŠ”£¬ĖłŅŌŌŚŗ¬µČĪļÖŹµÄĮæµÄKCN”¢KHCO3»ģŗĻČÜŅŗÖŠ£¬ŅõĄė×ӣسżOH-£©ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒc(HCO3-)>c(CN-)>c(CO32-)”££Ø5£©øł¾Ż·“Ó¦µÄ·½³ĢŹ½æÉÅŠ¶ĻĪ¢ÉśĪļ“¦Ąķ·ØµÄÓŵćŹĒ£¬¶ųȱµćŹĒĪ¢ÉśĪļŹŹÓ¦ŠŌ²īµČ”£
”££Ø3£©ĻõĖįÄÜÓėĢ¼ĖįĒāÄĘ·“Ӧɜ³ÉĢ¼Ėį£¬ĖµĆ÷µŖŌŖĖŲµÄ·Ē½šŹōŠŌĒæÓŚĢ¼ŌŖĖŲ£¬»Æѧ·“Ó¦·½³ĢŹ½ĪŖNaHCO3+HNO3=NaNO3+CO2”ü+H2O”££Ø4£©ŹŅĪĀĻĀ0.lmol/LK2CO3”¢KCN”¢KHCO3ČÜŅŗ¾ł³Ź¼īŠŌĒŅpHŅĄ“Ī¼õŠ”£¬ĖµĆ÷ĖįøłĄė×ÓµÄĖ®½ā³Ģ¶ČŅĄ“Ī¼õŠ”£¬ĖłŅŌŌŚŗ¬µČĪļÖŹµÄĮæµÄKCN”¢KHCO3»ģŗĻČÜŅŗÖŠ£¬ŅõĄė×ӣسżOH-£©ÅضČÓɓ󵽊”µÄĖ³ŠņŹĒc(HCO3-)>c(CN-)>c(CO32-)”££Ø5£©øł¾Ż·“Ó¦µÄ·½³ĢŹ½æÉÅŠ¶ĻĪ¢ÉśĪļ“¦Ąķ·ØµÄÓŵćŹĒ£¬¶ųȱµćŹĒĪ¢ÉśĪļŹŹÓ¦ŠŌ²īµČ”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶź³ÉĻĀĮŠ»ł±¾¼ĘĖć£ŗ
£Ø1£©9.2gµŖµÄŃõ»ÆĪļNOxÖŠµŖŌ×ÓµÄĪļÖŹµÄĮæĪŖ0.2mol£¬ŌņNOxµÄĦ¶ūÖŹĮæĪŖ________£¬“ĖÖŹĮæµÄNOxŌŚ±ź×¼×“æöĻĀµÄĢå»żŌ¼ĪŖ________£»
£Ø2£©19.2g CuÓė×ćĮæĻ”ĻõĖį·“Ó¦Ź±£¬×ŖŅʵē×Ó×ÜŹżŹĒ_____NA£ØNA±ķŹ¾°¢·š¼ÓµĀĀŽ³£Źż£©£»
£Ø3£©ŌŖĖŲMµÄijÖÖŌ×Ó£¬ĘäĀČ»ÆĪļ£ØMCl2£©11.1gÅä³ÉČÜŅŗŗ󣬊čÓĆ1mol/LµÄAgNO3ČÜŅŗ200mL²ÅÄÜ°ŃĀČĄė×ÓĶźČ«³ĮµķĻĀĄ“”£ŅŃÖŖøĆŌ×ÓÖŠ£ŗÖŹ×ÓŹż=ÖŠ×ÓŹż”£
¢Ł øĆŌ×ÓMµÄÖŹĮæŹżAĪŖ_____________”£
¢Ś Š“³öøĆŌ×Ó£ØŗĖĖŲ£©·ūŗÅ___________”£
¢Ū MŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ_______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹČÜÓŚĖ®Ź±»įĘĘ»µĖ®µÄµēĄėĘ½ŗā£¬ĒŅŹōÓŚµē½āÖŹµÄŹĒ£Ø £©
A. ĀČĘų
B. ĀČĖ®
C. ĀČ»Æ¼Ų
D. ĀČ»Æļ§
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾Żµē½āÖŹŌŚČÜŅŗÖŠµÄµēĄėĒéæö£¬ĪŅĆĒ»®·Ö³öĮĖĖį”¢¼ī”¢ŃĪ£¬ĶعżŃ§Ļ°ĪŅĆĒÖŖµĄĖįŗĶ¼ī¶¼ÓŠĶØŠŌ£¬¶ųŃĪŹĒƻӊĶØŠŌµÄ£¬Ęä±¾ÖŹŌŅņŹĒ£Ø £©
A.ŃĪ²»ÄܵēĄė³öŃōĄė×Ó
B.ŃĪ²»ÄܵēĄė³öŅõĄė×Ó
C.ŃĪ²»ÄܵēĄė³öH+»ņOH©
D.ŃĪ²»ÄܵēĄė³ö¹²Ķ¬µÄĄė×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠĖÄ×éĪļÖŹ£ŗ¢Ł“ÓµāµÄĖÄĀČ»ÆĢ¼ČÜŅŗÖŠ·ÖĄė³öµā£»¢Ś“ÓĀČ»ÆÄĘŗĶµ„ÖŹäåµÄĖ®ČÜŅŗÖŠ·ÖĄė³öä壻¢Ūŗ¬ÓŠĖ®·ŻµÄÖ²ĪļÓĶÖŠ³żČ„Ė®·Ż£»¢Ü·ÖĄė¶¹½¬ŗĶ¶¹Ōü£®·ÖĄėŅŌÉĻ»ģŗĻĪļµÄÕżČ··½·ØŅĄ“ĪŹĒ£Ø””””£©
A.ÕōĮó”¢ŻĶČ””¢·ÖŅŗ”¢¹żĀĖ
B.ŻĶČ””¢ÕōĮ󔢷ÖŅŗ”¢Õō·¢
C.ŻĶČ””¢ÕōĮ󔢷ÖŅŗ”¢¹żĀĖ
D.ÕōĮó”¢ŻĶČ””¢·ÖŅŗ”¢Õō·¢
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬¼øÖÖÄŃČÜĒāŃõ»ÆĪļµÄ±„ŗĶČÜŅŗÖŠ½šŹōĄė×ÓÅØ¶ČµÄøŗ¶ŌŹżÓėČÜŅŗµÄpH¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
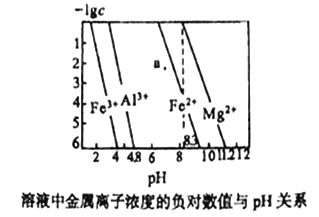
A. aµć“ś±ķFe(OH)2±„ŗĶČÜŅŗ
B. Ksp[Fe(OH)3]< Ksp[Al(OH)3]< Ksp[Fe(OH)2]< Ksp[Mg(OH)2]
C. Ļņ0.1mol/L Al3+”¢Mg2+”¢Fe2+»ģŗĻČÜŅŗÖŠ£¬ÖšµĪµĪ¼ÓĻ”NaOHČÜŅŗ£¬Mg2+×īĻČ³Įµķ
D. ŌŚpH=7µÄČÜŅŗÖŠ£¬Fe3+”¢Al3+”¢Fe2+ÄÜ“óĮæ¹²“ę
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠµēĄė·½³ĢŹ½ÖŠ£¬“ķĪóµÄŹĒ£Ø £©
A.H2CO3H++HCO3©£» HCO3©H++CO32©
B.H2SO4ØT2H++SO42©
C.NaHSØTNa++H++S2©
D.CH3COOHH++CH3COO©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ÓĆ0.10 mol”¤L-1NaOHČÜŅŗ·Ö±šµĪ¶Ø20.00 mLÅØ¶Č¾łĪŖ 0.10mol L-1µÄCH3COOH(Ka=1.75”Į10-5)ČÜŅŗŗĶHCN (Ka=4.9”Į10-10)ČÜŅŗĖłµĆµĪ¶ØĒśĻßČēĶ¼”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ĒśĻßIŗĶĒśĻߢņ·Ö±š“ś±ķµÄŹĒCH3COOHŗĶHCN
B. µć¢ŪŗĶµć¢ŻĖłŹ¾ČÜŅŗÖŠ£ŗc(CN-)=c(CH3COO-)
C. µć¢ŁŗĶµć¢ŚĖłŹ¾ČÜŅŗÖŠ£ŗc£ØCH3COO-£©-c£ØCN-£©=c£ØHCN£©-c£ØCH3COOH£©
D. ŌŚµć¢ŚŗĶ¢ŪÖ®¼ä£Ø²»°üĄØ¶Ėµć£©“ęŌŚ¹ŲĻµ£ŗ c(Na+)>c(A-)>c(H+)>c(OH-) (A-“ś±ķČÜŅŗÖŠµÄĖįøłĄė×Ó£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”放2015Õć½¾ķ”æŌŚ¹ĢĢ¬½šŹōŃõ»ÆĪļµē½ā³ŲÖŠ£¬øßĪĀ¹²µē½āH2O”ŖCO2»ģŗĻĘųĢåÖʱøH2ŗĶCOŹĒŅ»ÖÖŠĀµÄÄÜŌ“ĄūÓĆ·½Ź½£¬»ł±¾ŌĄķČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
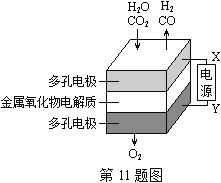
A£®XŹĒµēŌ“µÄøŗ¼«
B£®Ņõ¼«µÄ·“Ó¦Ź½ŹĒ£ŗH2O£«2e”„£½H2£«O2”„ CO2£«2e”„£½CO£«O2”„
C£®×Ü·“Ó¦æɱķŹ¾ĪŖ£ŗH2O£«CO2H2£«CO£«O2
D£®Ņõ”¢ŃōĮ½¼«Éś³ÉµÄĘųĢåµÄĪļÖŹµÄĮæÖ®±ČŹĒ1©U1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com