
 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )| A. | 太阳能最终转变为化学能 | B. | CeO2是水分解的催化剂 | ||
| C. | T<1050℃时,CeO2-δ比CeO2稳定 | D. | 两步反应均属于氧化还原反应 |
分析 A、由图可知太阳能最终转化为氧气和氢气中的能量;
B、CeO2在反应前后质量不变;
C、T<1050℃时,CeO2-δ转化成CeO2;
D、两步反应中都有元素化合价的变化.
解答 解:A、由图可知太阳能最终转化为氧气和氢气中的能量,所以将太阳能最终转变为化学能,故A正确;
B、CeO2在反应前后质量和性质不变,所以CeO2是水分解的催化剂,故B正确;
C、T<1050℃时,CeO2-δ转化成CeO2,所以CeO2比CeO2-δ稳定,故C错误;
D、两步反应中都有元素化合价的变化,第一步生成氧气单质、第二步生成氢气单质,所以两步反应均属于氧化还原反应,故D正确;
故选C.
点评 本题考查电解知识,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握氧化还原反应为解答关键.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
| 开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
| 完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 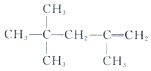 的名称为:2,2,4-三甲基-4-戊烯 的名称为:2,2,4-三甲基-4-戊烯 | |
| B. | 碳原子数小于或等于8的单烯烃,与HBr加成反应的产物只有一种结构,符合条件的单烯烃有6种 | |
| C. | 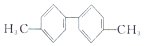 分子中至少有10个碳原子处于同一平面 分子中至少有10个碳原子处于同一平面 | |
| D. | 1 mol β-紫罗兰酮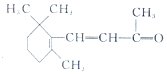 与1 mol H2发生加成反应可得到3种不同产物 与1 mol H2发生加成反应可得到3种不同产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 氧化还原反应 | D. | 复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
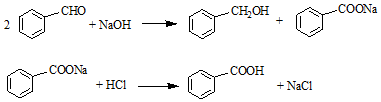
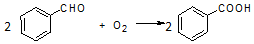
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
| 苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
| 苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
| 乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | -- | |
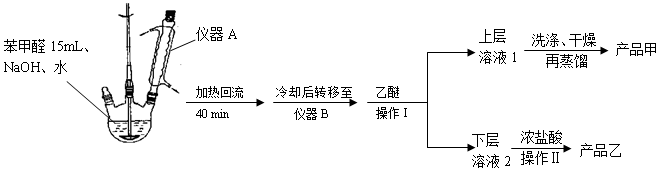
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
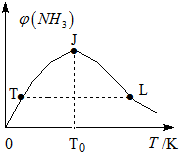 氢气是新型能源和重要化工原料.
氢气是新型能源和重要化工原料.| 容器编号 | 起始时各物质的物质的量/mol | 平衡时反应中的能量变化 | ||
| H2 | N2 | NH3 | ||
| Ⅰ | 3n | n | 0 | 放出热量a kJ |
| Ⅱ | 3n | 2n | 0 | 放出热量b kJ |
| Ⅲ | 6n | 2n | 0 | 放出热量c kJ |
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | … |
| NH3/mol | 2 | 1.0 | 0.5 | 0.25 | 0.24 | 0.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+H2O $\frac{\underline{\;高温\;}}{\;}$CO+H2 | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | Cl2+SO2+H2O=H2SO4+2HCl | D. | 2F2+2H2O=4HF+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com