
| A. | 滴加硫酸酸化的FeSO4溶液,平衡不移动 | |
| B. | 溶液颜色保持不变时,该反应达到平衡状态 | |
| C. | 滴加6 mol/L NaOH溶液,溶液颜色变深 | |
| D. | 平衡常数表达式为K=$\frac{2c(Cr{{O}_{4}}^{2-})•2c({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})•c({H}_{2}O)}$ |
分析 A、Fe2+会与Cr2O72-反应,同时酸化的溶液中H+浓度增大,使平衡逆向移动;
B、溶液的颜色是变量,当变量不变时已经平衡;
C、X溶液可能是NaOH溶液,和氢离子反应,化学平衡正向进行;
D、平衡常数应该为生成物浓度系数次方的乘积除以反应物浓度系数次方的乘积.
解答 解:A、向橙色的K2Cr2O7溶液中加入硫酸酸化的FeSO4溶液,Fe2+会与Cr2O72-反应,同时酸化的溶液中H+浓度增大,使平衡逆向移动,故A错误;
B、溶液的颜色是变量,当变量不变时已经平衡,故B正确;
C、X溶液可能是NaOH溶液,加入和氢离子反应,化学平衡正向进行,颜色变浅,故C错误;
D、平衡常数应该为生成物浓度系数次方的乘积除以反应物浓度系数次方的乘积,故D错误.
故选:B.
点评 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握反应离子特征和平衡移动方向是关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①③⑥ | C. | ②③④ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4句 | B. | 5句 | C. | 6句 | D. | 7句 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
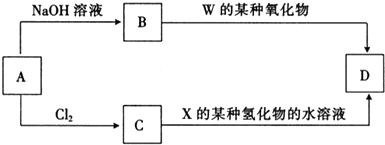
| W | X | ||
| Y | Z |
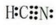 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2的体积为22.4L | |
| B. | 在0℃101KPa时,22.4L氢气中含有NA个氢原子 | |
| C. | 14g氮气中含有7NA个电子 | |
| D. | NA个CO和0.5molCH4的质量比为7:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com