
| A. | 25℃与60℃时,水的pH相等 | |
| B. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 | |
| C. | 常温,在0.10mol/L的NH3•H2O溶液中加入少量NH4Cl晶体,能使NH3•H2O的电离度降低,溶液pH值减小 | |
| D. | 向沸水中加入适量饱和的FeCl3溶液,可形成带电的胶体,其导电能力增强 |
分析 A.水的电离是吸热过程,加热促进电离,氢离子浓度增大;
B.氯化铁水解生成氢氧化铁和盐酸,盐酸为挥发性酸,硫酸铁在水中水解生成氢氧化铁和硫酸,硫酸为难挥发性酸;
C.NH3•H2O为弱电解质,发生NH3•H2O?NH4++OH-,加入少量NH4Cl晶体后,NH4+离子浓度增大,抑制NH3•H2O电离,平衡向逆向移动;
D.氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性.
解答 解:A.水的电离是吸热过程,加热促进电离,氢离子浓度增大,25℃与60℃时,水的pH不相等,60℃PH小,故A错误;
B.在FeCl3溶液中,Fe3+发生水解生成Fe(OH)3:FeCl3+3H2O?Fe(OH)3+3HCl,由于加热蒸发,使HCl挥发,破坏平衡,使平衡不断向右移动,结果生成Fe(OH)3,又由于灼热发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,使Fe(OH)3分解生成Fe2O3,Fe2 (SO4)3;在水中水解生成氢氧化铁和硫酸,硫酸为难挥发性酸,所以最终得到的产物是Fe2 (SO4)3,故B错误;
C.向氨水中加入氯化铵晶体,铵根离子浓度增大,抑制NH3•H2O电离,则NH3•H2O电离程度减小,NH4+离子浓度增大,平衡向逆向移动,c(OH-)变小,pH减小,故C正确;
D.向沸水中加入适量饱和的FeCl3溶液,制得Fe(OH)3胶体,胶体微粒能吸附带电粒子导电,但胶体是中性的分散系,不带电荷,故D错误;
故选C.
点评 本题考查了弱电解质的电离、盐类水解,侧重于学生的分析能力的考查,为高频考点,明确弱电解质电离特点及影响弱电解质电离的因素是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
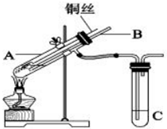 (1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.
(1)用铜与浓硫酸反应制取硫酸铜,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率变大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
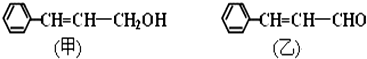
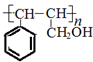 .
.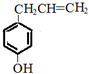 .
.
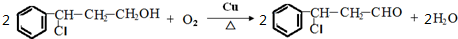 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
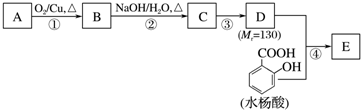
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com