
【题目】为探究氯水中含有的粒子及其性质,某化学小组做了如下实验:
(1)观察氯水颜色,发现氯水呈浅黄绿色,证明氯水中含有的粒子是____(填粒子符号)。
(2)向氯水中滴入Na2CO3溶液,有气体生成,说明氯水中含有的粒子是___(填粒子符号)。
(3)氯水经光照后,观察到的现象是_______,溶液的酸性_____(填“增强”“不变”或“减弱”)。
(4)氯水中具有氧化性的含氯微粒有_______(填粒子符号)。
【答案】Cl2 H+ 溶液黄绿色变浅甚至于变成无色,有气泡产生 增强 Cl2、ClO-、HClO
【解析】
新制的氯水中存在“三分子四离子”,三分子为Cl2、H2O、HClO,四离子为H+、OH-、Cl-、ClO-,据此分析作答。
(1)新制的氯水中存在Cl2,因此氯水呈浅黄绿色;
(2)新制的氯水中存在H+,H+与CO32-结合生成CO2和H2O;
(3)氯水经光照后氯气分子逐渐挥发,次氯酸见光分解,因此可以看到溶液黄绿色变浅甚至于变成无色,有气泡产生;
(4)新制氯水中存在“三分子四离子”,其中具有氧化性的含氯微粒为Cl2、ClO-、HClO。
参与反应 的微粒 | 所加试剂 (或材料) | 实验现象 | 离子方程式或解释 |
Cl- | 硝酸酸化的AgNO3溶液 | 白色沉淀 | Cl-+Ag+===AgCl↓ |
H+ | Na2CO3固体 | 有气泡 产生 | 2H++CO CO2↑+H2O |
HClO | 有色布条 | 布条颜 色褪去 | HClO具有漂白性 |
Cl2 | FeCl2溶液 | 溶液由浅黄绿色变为棕黄色 | 2Fe2++Cl2=== 2Fe3++2Cl- |
Cl2、H2O | SO2 | 溶液浅黄绿色褪去 | SO2+Cl2+2H2O=== 4H++2Cl-+SO |
H+、HClO | 石蕊溶液 | 溶液先变红后褪色 | 酸性和漂白性 |


科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
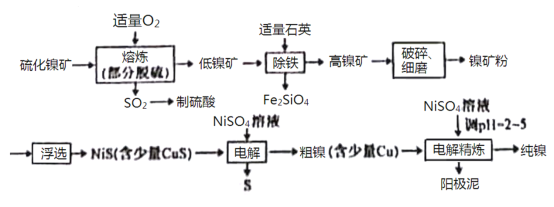
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是某合成农药的中间体,其结构为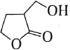 。下列有关的说法正确的是( )
。下列有关的说法正确的是( )
A.M能发生取代反应和加成反应
B.1molM与足量的NaOH溶液反应,最多可消耗2molNaOH
C.分子中有5个碳原子共平面
D.同时含有-CHO和-COOH结构的M的同分异构体有5种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量的二氧化锰和40mL 10mol/L浓盐酸充分反应制氯气,下列说法正确的是
A.该实验中共消耗0.1 mol MnO2,生成标准状况下2.24L氯气
B.氯气有毒、有刺激性气味,常用澄清石灰水吸收多余的氯气
C.氯气可以用向下排空气法或排水法收集
D.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是
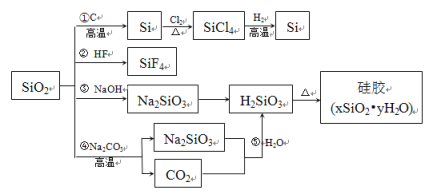
A.SiO2既能发生②反应,又能发生③反应,说明SiO2属于两性氧化物
B.④反应是水泥工业的化学反应原理之一,⑤反应可证明H2CO3酸性强于H2SiO3
C.①反应的生成物除Si外还有CO2,硅胶可用作催化剂的载体
D.除了粗硅的制备和提纯过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际社会高度赞扬中国在应对新冠肺炎疫情时所采取的措施。疫情防控中要对环境进行彻底消毒,二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2的原理如图所示。下列说法正确的是( )
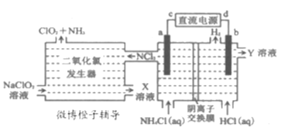
A.c为电源的负极,在b极区流出的Y溶液是浓盐酸
B.电解池a极上发生的电极反应为NH4+-6e-+3Cl-=NCl3+4H+
C.二氧化氯发生器内,发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为6:1
D.当有0.3mol阴离子通过离子交换膜时,二氧化氯发生器中产生1.12LNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志于2018年3月15日发布,中国留学生曹原用石墨烯实现了常温超导。这一发现将在很多领域发生颠覆性的革命。镓(Ga)、硒(Se)的单质及某些化合物如砷化镓等都是常用的半导体材料,超导和半导体材料都广泛应用于航空航天测控、光纤通讯等领域。请回答下列与碳、砷、镓、硒有关的问题。
(1)基态硒原子的核外价层电子排布式为___,与硒同周期的p区元素中第一电离能大于硒的元素有___种,SeO3的空间构型是___。
(2)化合物[EMIM][AlCl4]具有很高的应用价值,EMIM+结构如图所示。
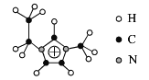
①EMIM+离子中各元素电负性由大到小的顺序是___。
②EMIM+离子中碳原子的杂化轨道类型为___。
③大π键可用符号π![]() 表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
表示,其中m、n分别代表参与形成大π键的原子数和电子数,则EMIM+离子中的大π键应表示___。
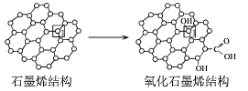
(3)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯如图所示,转化后1号C原子与相邻C原子间键能变小,原因是___。
(4)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示,Ga和As的原子半径分别为apm和bpm,GaAs晶胞中原子的体积占晶胞体积的百分率为A,则阿伏加德罗常数的值为NA=___。(用字母表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.Cl2 +H2O![]() HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
HCl+HClO光照新制的氯水时,颜色变浅,溶液的酸性增强
B.CO2(aq)![]() CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
CO2(g)打开可乐瓶,有大量气泡从溶液中冒出
C.I2(g)+H2(g) ![]() 2HI(g)的平衡体系,加压后颜色变深
2HI(g)的平衡体系,加压后颜色变深
D.2NO2(g)![]() N2O4(aq)加压后颜色先变深后变浅
N2O4(aq)加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作及装置正确的是
A.配制一定物质的量浓度的 NaOH溶液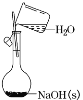
B.比较 NaHCO3和 Na2 CO3 的热稳定性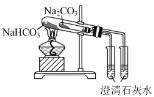
C.制取并观察 Fe(OH)2沉淀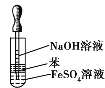
D.蒸馏海水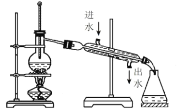
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com