
设NA为阿伏加德罗常数,下列叙述正确的是
A.红磷在氯气中反应,1mol红磷失去的电子数一定为5NA
B.标准状况下22.4L C3H8中含中子数为18NA
C.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA个
D.常温下78 g过氧化钠和122 g水混合,所得溶液质量分数为40%
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:2016届内蒙古赤峰二中高三上学期12月月考理综化学试卷(解析版) 题型:实验题
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验。
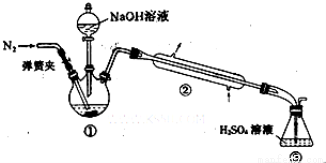
Ⅰ.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温后,称重,质量为5.68g。
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入氮气,用40.00mL 1mol•L-1的硫酸溶液吸收产生氨气。蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液。
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的物质全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6g。回答下列问题:
(1)在实验I中,不可能用到的实验仪器是________(填正确答案标号)
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿 E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是____________。
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用______式滴定管;可使用的指示剂为_______;若在滴加氢氧化钠溶液时有少量待测液溅出,会使测量值________。
(4)在实验中,检验沉淀是否洗净的方法是________________。
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为_____________,三颈瓶中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高一上期中考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.钠和水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B.铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C.氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣=BaSO4↓
D.在氯化亚铁溶液中通入氯气:Cl2+Fe2+=Fe3++2Cl﹣
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中理化学试卷(解析版) 题型:实验题
实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和Cu | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
氢氰酸(HCN) | 碳酸(H2CO3) | 氢氟酸(HF) |
K = 6.2×10-10 | Ka1= 4.2×10-7 | K=6.61×10-4 |
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2 mol•L-1 HCN溶液与0.1 mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
查看答案和解析>>
科目:高中化学 来源:2016届四川成都第七中学高三阶段测试三理综化学试卷(解析版) 题型:选择题
用下列装置不能达到有关实验目的的是( )

A.用甲图装置电解精炼铝
B.用乙图装置制备氢氧化亚铁
C.用丙图装置可制得金属锰
D.用丁图装置验证碳酸氢钠和碳酸钠的热稳定性
查看答案和解析>>
科目:高中化学 来源:2016届山西平遥中学等重点中学高三第三次练兵化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.常温常压下,92g的二氧化氮和四氧化二氮的混合气体中含有原子数为6NA
B.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
C.0.25mol过氧化钠中含有的阴离子数为0.5NA
D.在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol碘转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:选择题
下列有关阿伏伽德罗常数NA说法错误的是
A.22 g 2H218O中含有的质子数为10NA
B.电解58.5 g熔融的NaCl,能产生11.2 L氯气(标准状况)、23.0 g金属钠
C.1.00 mol NaCl中,所有Na+的最外层电子总数为10NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建三明一中高一上学期第二次月考化学卷(解析版) 题型:选择题
下列关于氨水的叙述正确的是
A.氨水显碱性,是因为氨水是一种弱碱
B.氨水和液氨成分相同
C.氨水中物质的量浓度最大的粒子是NH3·H2O(除水外)
D.氨水中共有五种粒子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com