
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
分析 A.酸或碱都抑制水电离,且酸中c(H+)越大,其抑制水电离程度越大;
B.醋酸是弱酸、HCl是强电解质,所以pH相同的醋酸、盐酸,c(CH3COOH)>c(HCl),中和等物质的量的NaOH溶液,酸的浓度越大,消耗的酸体积越小;
C.等体积等pH的醋酸和盐酸,n(CH3COOH)>n(HCl),分别与足量的Al发生置换反应,酸的物质的量越大,生成的氢气越多;
D.pH相同的醋酸、盐酸,c(CH3COOH)>c(HCl),加水稀释促进醋酸电离,等体积等pH的醋酸和盐酸,稀释相同的倍数,醋酸中c(H+)大于盐酸.
解答 解:A.酸或碱都抑制水电离,且酸中c(H+)越大,其抑制水电离程度越大,这两种酸中氢离子浓度相同,所以抑制水电离程度相同,故A错误;
B.醋酸是弱酸、HCl是强电解质,所以pH相同的醋酸、盐酸,c(CH3COOH)>c(HCl),中和等物质的量的NaOH溶液,酸的浓度越大,消耗的酸体积越小,因为n(CH3COOH)>n(HCl),所以醋酸消耗的体积小些,故B正确;
C.等体积等pH的醋酸和盐酸,n(CH3COOH)>n(HCl),分别与足量的Al发生置换反应,酸的物质的量越大,生成的氢气越多,所以生成H2的质量:①>②,故C错误;
D.pH相同的醋酸、盐酸,c(CH3COOH)>c(HCl),加水稀释促进醋酸电离,等体积等pH的醋酸和盐酸,稀释相同的倍数,醋酸中c(H+)大于盐酸,所以溶液的pH:①<②,故D错误;
故选B.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离特点是解本题关键,注意:等pH的一元酸,弱酸浓度大于强酸,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(O2)=0.15mol•L-1•min-1 | ||
| C. | v(NO)=0.2mol•L-1•min-1 | D. | v(H2O)=0.25mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
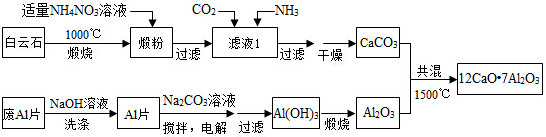
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol/L的纯碱溶液:c(CO32-)=0.01mol/L | |
| B. | 在Na2S稀溶液中,c(H+)=c(OH-)+2c(H2S)+c(HS-) | |
| C. | CaCO3难溶于稀硫酸,也难溶于醋酸 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
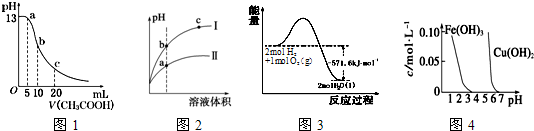
| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.1mol/L的①CH3COOH ②NH4Cl ③H2SO4三种溶液中,由水电离出的c(H+):①>③>② | |
| B. | 常温下,pH=2与pH=3的CH3COOH溶液,前者的c(CH3COOH)是后者的10倍 | |
| C. | 任意稀盐酸中c(H+)的精确计算式可以表示为c(H+)=c(Cl-)+Kw/c(OH-) | |
| D. | 同c(NH4+)的溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4溶液,物质的量浓度最大的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
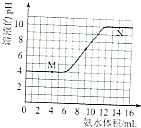 常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )
常温下,用一定浓度的氨水滴定一定体积未知浓度的土壤浸出溶液,溶液的pH变化与滴入氨水体积的关系如图所示,下列有关说法不正确的是( )| A. | 该土壤是酸性土壤 | |
| B. | 当溶液中c(H+)=c(OH-)时,消耗氨水的体积为9mL | |
| C. | M、N点由水电离出的氢离子浓度一定相等 | |
| D. | 将20mL此氨水与10mL同浓度的盐酸混合,充分反应后存在:C(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
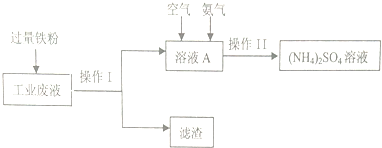
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com